题目内容
3.某溶液中可能含有K+、Ba2+、NH4+、S2-、I-、SO42-,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )| A. | K+ | B. | NH4+ | C. | SO42- | D. | S2- |
分析 利用淀粉遇碘单质变蓝来结合信息加氯水和淀粉无明显现象来分析存在的离子,然后利用离子的共存及溶液呈电中性来分析还存在的离子和一定没有的离子,而对于不能确定的离子,则是还需检验的离子来解答.
解答 解:由①可知溶液显酸性,说明溶液中含有H+,
由氯水能氧化I-生成碘单质,而碘遇淀粉变蓝,而②中加氯水和淀粉无明显现象,则一定不含有I-;
又溶液呈电中性,有阳离子必有阴离子,则溶液中有H+,必须同时存在阴离子,即SO42-必然存在,而Ba2+、SO42-能结合生成沉淀,则这两种离子不能共存,即一定不存在Ba2+;显然剩下的K+是否存在无法判断,则需检验的离子是K+,
故选A.
点评 本题考查溶液中的离子判断,学生明确离子的共存、离子的检验、溶液呈电中性等知识是解答的关键,有助于训练学生解决问题时思维的严密性.

练习册系列答案
相关题目
13.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子.根据以上叙述,下列说中正确的是( )
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
14.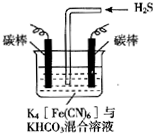 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3- | |
| B. | 电解过程中阴极区溶液的pH变大 | |
| C. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| D. | 通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓ |
11.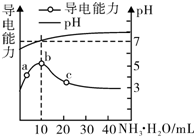 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )| A. | HR为强酸 | |
| B. | 加入10 mL 氨水时,溶液中c(NH4+)>c(R-) | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b点的离子浓度大于a点的离子浓度 |
8.下列与生活实际或常见的现象相关的叙述错误的是( )
| A | B | C | D |
 利用燃气烧饭 |  古代制取陶瓷技术 |  萃取得到玫瑰精油 |  铁制品容易生锈 |
| 燃料的燃烧是氧化还原反应 | 用黏土制取陶瓷的原理属于化学变化 | 玫瑰花中萃取玫瑰精油属于化学变化 | 在船身上装锌块可避免船体遭受腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | 淀粉溶液与少量硫酸共热后,加NaOH溶液至碱性,再加碘水无明显现象,说明淀粉已水解完全 | |
| B. | 称取一定量已潮解的NaOH,配成一定体积溶液,取该溶液滴定未知浓度盐酸,则盐酸测定浓度偏高 | |
| C. | 电器设备所引起的火灾,可用二氧化碳或四氯化碳灭火器灭火,也可用泡沫灭火器灭火 | |
| D. | 往硫酸铝溶液中加入过量氨水,溶液先浑浊后澄清,说明氢氧化铝具有两性 |
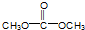 简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下:
简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下: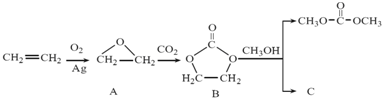

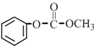 ;
;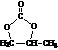 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)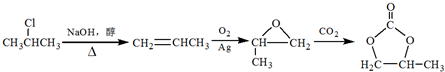 .合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.
.合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.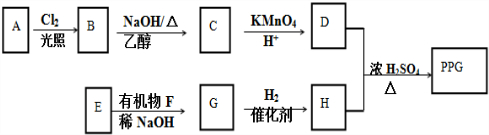
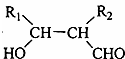
 .
. .
. .
.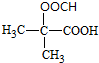 .
.
 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)