题目内容
氮化铝(AlN)是一种新型无机非金属材料.某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案.(已知:AIN+NaOH+H2O═NaAIO2+NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
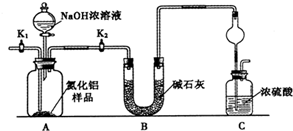
(1)如图C装置中球形干燥管的作用是 .
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品.接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是 .
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 .
【方案2】用如图装置测定m g样品中A1N的纯度(部分夹持装置已略去).
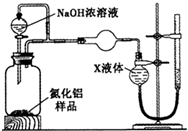
(4)为测定生成气体的体积,量气装置中的X液体可以是 .
a.CCl4 b.H2O
c.NH4Cl溶液 d.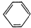
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是 .
【方案3】按以下步骤测定样品中AlN的纯度:
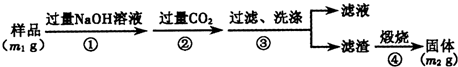
(6)步骤②生成沉淀的离子方程式为 .
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”).
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).

(1)如图C装置中球形干燥管的作用是
(2)完成以下实验步骤:组装好实验装置,首先
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见
【方案2】用如图装置测定m g样品中A1N的纯度(部分夹持装置已略去).

(4)为测定生成气体的体积,量气装置中的X液体可以是
a.CCl4 b.H2O
c.NH4Cl溶液 d.

(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是
【方案3】按以下步骤测定样品中AlN的纯度:

(6)步骤②生成沉淀的离子方程式为
(7)若在步骤③中未洗涤,测定结果将
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
(4)依据氨气极易溶于水的性质分析判断;
(5)依据化学方程式定量关系计算得到;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成;
(7)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高.
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
(4)依据氨气极易溶于水的性质分析判断;
(5)依据化学方程式定量关系计算得到;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成;
(7)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高.
解答:
解:(1)分析装置和仪器作用分析,氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性,关闭K1,打开K2,把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,故答案为:C装置出口处连接一个干燥装置;
(4)依据氨气极易溶于水的性质分析,为测定生成气体的体积,量气装置中的X液体可以是;
a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确;
故选ad.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AIN+NaOH+H2O═NaAIO2+NH3↑
41 22.4L
m V×10-3L
m=
则AlN的质量分数=
×100%=
×100%,
故答案为:
×100%;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(7)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高.
故答案为:防止倒吸;
(2)组装好实验装置,原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性,关闭K1,打开K2,把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,故答案为:C装置出口处连接一个干燥装置;
(4)依据氨气极易溶于水的性质分析,为测定生成气体的体积,量气装置中的X液体可以是;
a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确;
故选ad.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AIN+NaOH+H2O═NaAIO2+NH3↑
41 22.4L
m V×10-3L
m=
| 41V×10-3 |
| 22.4 |
则AlN的质量分数=
| 41V×10-3 |
| 22.4m |
| 41V |
| 22400m |
故答案为:
| 41V |
| 22400m |
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(7)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高.
点评:本题考查了物质性质的探究实验设计和实验分析判断,实验基本操作和我物质性质的掌握是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关离子(或物质)的检验及结论正确的是( )
| A、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| B、向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C、向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D、向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银分别放入下列溶液中,相同温度下c(Ag+)最大的是( )
| A、100mL蒸馏水 |
| B、100mL 0.2mol?L-1 AgNO3 |
| C、100 mL 0.1mol?L-1 AlCl3 |
| D、100mL 0.1 mol?L-1盐酸 |
下列实验操作不能达到目的是( )
| A、除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸 |
| B、制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性 |
| C、检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡 |
| D、使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液 |
随着社会的发展,人们日益重视环境问题、节能减排,下列说法不正确的是( )
| A、绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染 |
| B、大力开发和应用氢能源有利于实现“低碳经济” |
| C、吸烟不会造成室内PM2.5污染 |
| D、采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |
 仔细观察下面两种电池的构造示意图,完成下列问题:
仔细观察下面两种电池的构造示意图,完成下列问题: