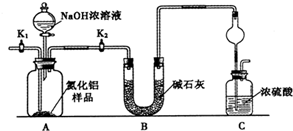
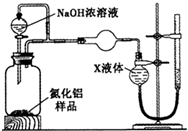
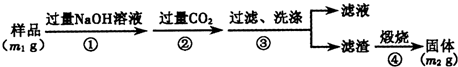
题目内容
下列实验操作不能达到目的是( )
| A、除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸 |
| B、制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性 |
| C、检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡 |
| D、使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液 |
考点:化学实验方案的评价,物质的分离、提纯和除杂,物质的检验和鉴别的实验方案设计
专题:实验评价题
分析:A.加入MgCO3,增大溶液pH,促进Fe3+水解;
B.应避免胶体聚沉;
C.FeSO4与酸性高锰酸钾发生氧化还原反应;
D.氯化铵促进氢氧化镁的电离.
B.应避免胶体聚沉;
C.FeSO4与酸性高锰酸钾发生氧化还原反应;
D.氯化铵促进氢氧化镁的电离.
解答:
解:A.加入MgCO3,增大溶液pH,促进Fe3+水解,生成氢氧化铁沉淀,且不引入新的杂质,故A正确;
B.加入过量盐酸可使胶体聚沉,故B错误;
C.FeSO4与酸性高锰酸钾发生氧化还原反应,可用于检验,故C正确;
D.氯化铵促进氢氧化镁的电离,使溶解平衡向正向移动,故D正确.
故选B.
B.加入过量盐酸可使胶体聚沉,故B错误;
C.FeSO4与酸性高锰酸钾发生氧化还原反应,可用于检验,故C正确;
D.氯化铵促进氢氧化镁的电离,使溶解平衡向正向移动,故D正确.
故选B.
点评:本题考查较为综合,涉及物质的分离、检验等知识,为高考常见题型,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式书写正确的是( )
| A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | ||||
B、向铜作电极电解硫酸溶液:2H2O
| ||||
| C、向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | ||||
| D、向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ |
A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,B的最外层电子是电子层数的三倍,C的焰色反应呈黄色,下列说法正确的是( )
| A、元素A在周期表中的位置为第2周期ⅥA族 |
| B、元素A、B、C的原子半径由大到小的顺序为r(C)>r(B)>r(A) |
| C、A、B两种元素的氢化物的稳定性A>B |
| D、1mol C2B2与足量的AB2完全反应转移约6.02×1023个电子 |
在一定温度条件下,对于已达到平衡的反应:FeCl3+3KSCN?3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是( )
| A、加入少量氯化钾固体 |
| B、加入少量氯化铁固体 |
| C、减少Fe(SCN)3的浓度 |
| D、加水稀释 |
常温下有0.1mol?L-1的NaHC2O4溶液,其pH=4,下列说法正确的是( )
| A、c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) |
| B、c(H2C2O4)>c(C2O42-) |
| C、c(H+)+c(Na+)=c(OH-)+c(C2O42-)+c(HC2O4-) |
| D、c(Na+)>c(HC2O4-)>c(H+)>c(OH-) |
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、空气、SO2、NO、NO2 |
| B、KNO3溶液、Fe2+、H+、I- |
| C、NaHCO3溶液、Ca2+、OH-、Cl- |
| D、由水电离产生的c(H+)=10-11mol?L-1的溶液K+、SO42-、Br- |
X、Y、Z、W是原子序数依次递增的短周期元素,4种元素的原子最外层电子数之和为16,X与其它元素不在同一周期和同一主族,Y的阴离子与Z的阳离子具有相同的电子层结构,W原子得到一个电子后可形成与某稀有气体原子核外电子排布相同的稳定结构.下列说法合理的是( )
| A、简单离子半径:W>Z>Y |
| B、X与Y形成的化合物中,既含极性键又含非极性键的物质至少有2种 |
| C、Z与W形成的化合物一定是离子化合物 |
| D、Y的最高价氧化物对应的水化物的酸性一定比W的弱 |