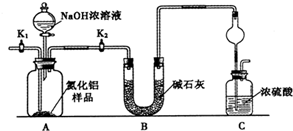
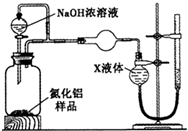
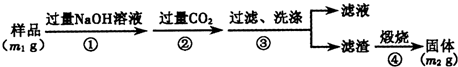
题目内容
下列叙述和解释正确的是( )
| 选项 | 叙述 | 原因或解释 |
| A | SO2通入氢氧化钠酚酞溶液中,溶液褪色 | SO2具有漂白作用 |
| B | 将浓硫酸滴到蔗糖表面,固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| C | 过滤时应用玻璃棒引流和搅拌 | 防止滤液溅出和缩短过滤时间 |
| D | 浓硝酸应保存在棕色瓶中 | 浓硝酸易挥发 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.二氧化硫与氢氧化钠发生中和反应;
B.蔗糖变黑,说明浓硫酸具有脱水性,体积膨胀,说明生成气体,表现了浓硫酸的强氧化性;
C.过滤时要防止滤纸破损;
D.浓硝酸易分解.
B.蔗糖变黑,说明浓硫酸具有脱水性,体积膨胀,说明生成气体,表现了浓硫酸的强氧化性;
C.过滤时要防止滤纸破损;
D.浓硝酸易分解.
解答:
解:A.二氧化硫与氢氧化钠发生中和反应,不是漂白性,故A错误;
B.蔗糖变黑,说明浓硫酸具有脱水性,体积膨胀,说明生成气体,表现了浓硫酸的强氧化性,故B正确;
C.过滤时不能用玻璃棒搅拌,防止滤纸破损,故C错误;
D.浓硝酸易分解,应避光保存,与挥发性无关,故D错误.
故选B.
B.蔗糖变黑,说明浓硫酸具有脱水性,体积膨胀,说明生成气体,表现了浓硫酸的强氧化性,故B正确;
C.过滤时不能用玻璃棒搅拌,防止滤纸破损,故C错误;
D.浓硝酸易分解,应避光保存,与挥发性无关,故D错误.
故选B.
点评:本题考查较为综合,涉及物质的性质、分离以及保存等知识,为高考常见题型,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中已铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中已铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A、阳极电极方程式为Al-3e+6OH-=Al2O3+H2O |
| B、随着电解的进行,溶液的PH逐渐增大 |
| C、当阴极生成气体3.36L(标况)时,阳极增重2.4g |
| D、电解过程中H+移向Al电极 |
下列行为中,符合安全要求的是( )
| A、严禁在加油站附近燃放烟花爆竹 |
| B、金属钠意外着火时,立即用沾水的毛巾覆盖 |
| C、当有大量氯气泄漏时,人应沿顺风方向疏散 |
| D、将含有硫酸的废液倒入水池,用大量水冲入下水道 |
A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,B的最外层电子是电子层数的三倍,C的焰色反应呈黄色,下列说法正确的是( )
| A、元素A在周期表中的位置为第2周期ⅥA族 |
| B、元素A、B、C的原子半径由大到小的顺序为r(C)>r(B)>r(A) |
| C、A、B两种元素的氢化物的稳定性A>B |
| D、1mol C2B2与足量的AB2完全反应转移约6.02×1023个电子 |
在一定温度条件下,对于已达到平衡的反应:FeCl3+3KSCN?3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是( )
| A、加入少量氯化钾固体 |
| B、加入少量氯化铁固体 |
| C、减少Fe(SCN)3的浓度 |
| D、加水稀释 |
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、空气、SO2、NO、NO2 |
| B、KNO3溶液、Fe2+、H+、I- |
| C、NaHCO3溶液、Ca2+、OH-、Cl- |
| D、由水电离产生的c(H+)=10-11mol?L-1的溶液K+、SO42-、Br- |
下列方程式正确的是( )
| A、碳酸的电离方程式为 H2CO3?2H++CO32- |
| B、乙酸钠的水解方程式 CH3COO-+H3O+?CH3COOH+H2O |
| C、偏铝酸钠和过量盐酸反应离子方程式AlO2-+4H+=Al3++2H2O |
| D、苯酚钠溶液中通入少量二氧化碳的离子方程式 2C6H5O-+CO2=2C6H5OH+CO32- |