题目内容
 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式:
(4)d点时,V(NaOH)约为
(Ⅱ)常温下有浓度均为0.5mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值
(2)若将③和④的溶液混合后溶液恰好呈中性则混合前③的体积
考点:镁、铝的重要化合物,离子方程式的书写,盐类水解的应用
专题:
分析:(Ⅰ) (1)硫酸铝为强酸弱碱盐,水解显酸性;
(2)c点后pH发生突变,NaOH过量;
(3)a-b段,发生氢离子与碱中和反应,且溶液总体积增大;
(4)d点时,溶液刚好是偏铝酸钠溶液,据铝离子和氢氧根应该为1:4进行计算;
(Ⅱ)(1)向氨水中加入氯化铵抑制一水合氨电离;
(2)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,根据溶液酸碱性结合电荷守恒判断离子浓度大小..
(2)c点后pH发生突变,NaOH过量;
(3)a-b段,发生氢离子与碱中和反应,且溶液总体积增大;
(4)d点时,溶液刚好是偏铝酸钠溶液,据铝离子和氢氧根应该为1:4进行计算;
(Ⅱ)(1)向氨水中加入氯化铵抑制一水合氨电离;
(2)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,根据溶液酸碱性结合电荷守恒判断离子浓度大小..
解答:
解:(Ⅰ) (1)硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+,故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,所以铝离子和氢氧根应该为1:3,则Al2(SO4)3溶液的物质的量浓度约为
=0.5mol/L,故答案为:0.5mol/L;
(3)b-c段,pH变化不大,主要发生Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀,故答案为:Al3++3OH-═Al(OH)3↓;
(4)d点时,溶液刚好是偏铝酸钠溶液,所以铝离子和氢氧根应该为1:4,则V(NaOH)约为
=120ml,故答案为:120ml;
(Ⅱ)(1)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,所以
的值增大,故答案为:增大;
(2)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Cl-)=c(NH4+),中性溶液中水的电离程度很小,所以离子浓度大小顺序是c(Cl-)=c(NH4+)>c(OH-)=c(H+),故答案为:小于;c(Cl-)=c(NH4+)>c(OH-)=c(H+).
(2)c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,所以铝离子和氢氧根应该为1:3,则Al2(SO4)3溶液的物质的量浓度约为
| ||||
| 30 |
(3)b-c段,pH变化不大,主要发生Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀,故答案为:Al3++3OH-═Al(OH)3↓;
(4)d点时,溶液刚好是偏铝酸钠溶液,所以铝离子和氢氧根应该为1:4,则V(NaOH)约为
| 0.5×30×2×4 |
| 1.0 |
(Ⅱ)(1)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,所以
| c(NH 4 +) |
| c(OH -) |
(2)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Cl-)=c(NH4+),中性溶液中水的电离程度很小,所以离子浓度大小顺序是c(Cl-)=c(NH4+)>c(OH-)=c(H+),故答案为:小于;c(Cl-)=c(NH4+)>c(OH-)=c(H+).
点评:本题侧重盐类水解及复分解反应的考查以及离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大,注意氢氧化铝的两性及图中c点pH突变为解答的关键.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、伴有能量变化的物质变化都是化学变化 |
化学与资源、环境、生活关系密切,下列说法错误的是( )
| A、维生素C具有还原性,在人体内起抗氧化作用 |
| B、新型氢动力计程车可以降低PM2.5的排放,减少大气污染 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液会“断路” |
随着社会的发展,人们日益重视环境问题,下列做法或说法正确的是( )
| A、对农作物秸秆进行焚烧还田,以增加土壤肥力 |
| B、为提高农作物产量大量使用农药和化肥 |
| C、PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
| D、推广使用无磷洗衣粉,以减少水体富营养化 |
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
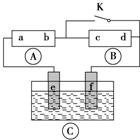
 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( ) 
| A、b为直流电源的负极 |
| B、f极为阴极,发生还原反应 |
| C、e极材料为铁片,f极材料的铜片 |
| D、可选用CuSO4溶液或CuCl2溶液作电镀液 |
下列反应中必须加入还原剂才能进行的是( )
| A、FeCl3→FeCl2 |
| B、Zn→Zn2+ |
| C、H2→H2O |
| D、CuO→CuCl2 |
 某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: