题目内容
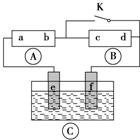
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
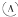 为直流电源,
为直流电源,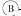 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现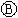 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( ) 
| A、b为直流电源的负极 |
| B、f极为阴极,发生还原反应 |
| C、e极材料为铁片,f极材料的铜片 |
| D、可选用CuSO4溶液或CuCl2溶液作电镀液 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电顺序氯气,则a是直流电源正极,b是直流电源负极,以此解答该题.
解答:
解:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电顺序氯气,则a是直流电源正极,b是直流电源负极,
A.由以上分析可知b为直流电源的负极,故A正确;
B.f连接电源的负极,为阴极,发生还原反应,故B正确;
C.在铁上镀铜,铁为阴极,则f为铁,故C错误;
D.电解质溶液应含有铜离子,可为CuSO4溶液或CuCl2溶液,故D正确.
故选C.
A.由以上分析可知b为直流电源的负极,故A正确;
B.f连接电源的负极,为阴极,发生还原反应,故B正确;
C.在铁上镀铜,铁为阴极,则f为铁,故C错误;
D.电解质溶液应含有铜离子,可为CuSO4溶液或CuCl2溶液,故D正确.
故选C.
点评:本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,正确推断直流电源正负极是解本题关键,难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
在2L Fe2(SO4)3和CuSO4的混合溶液中,加入30g纯铁粉,最后得到2L 0.25mol/L的FeSO4溶液和26g固体沉淀物.求原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度.
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、100mL0.1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4 L |
| D、48gO2和O3的混合气体中氧原子数目为3NA |
根据下列三个反应的化学方程式:?I2+SO2+2H2O═H2SO4+2HI;2FeCl2+Cl2═2FeCl3,2FeCl3+2HI═2FeCl2+2HCl+I2有关物质的还原性依次增强的顺序是( )
?
?
| A、I->Fe2+>Cl->SO2 |
| B、Cl->Fe2+>SO2>I- |
| C、Fe2+>I->Cl->SO2 |
| D、SO2>I->Fe2+>Cl- |
下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是( )
| A、Cl2+H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、Na2O+H2O=2NaOH |
| D、2Na+H2O=2NaOH+H2 |
下列化合物中同分异构体数目最少的是( )
| A、己烷 | B、戊醇 |
| C、戊烯 | D、乙酸乙酯 |
下列反应中可用离子方程式H++OH-═H2O表示的是( )
| A、NH4Cl+NaOH═NaCl+NH3?H2O |
| B、Mg(OH)2+2HCl═MgCl2+2H2O |
| C、NaOH+NaHCO3═Na2CO3+H2O |
| D、NaOH+HNO3═NaNO3+H2O |
 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.