题目内容
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、伴有能量变化的物质变化都是化学变化 |
考点:反应热和焓变
专题:
分析:A、反应放热还是吸热与反应条件无关;
B、反应自发与否决定于焓变和熵变两个因素;
C、从反应热的概念出发分析;
D、物理变化有时也伴随着能量变化.
B、反应自发与否决定于焓变和熵变两个因素;
C、从反应热的概念出发分析;
D、物理变化有时也伴随着能量变化.
解答:
解:A、燃烧需要加热到着火点,都是放热反应,故A错误;
B、着火点比较高的物质燃烧需要加热到较高温度,故B错误;
C、反应热等于生成物能量和与反应物能量和之差,即反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小,故C正确;
D、伴有能量变化的物质变化不一定都是化学变化,也可能是物理变化,故D错误;
故选C.
B、着火点比较高的物质燃烧需要加热到较高温度,故B错误;
C、反应热等于生成物能量和与反应物能量和之差,即反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小,故C正确;
D、伴有能量变化的物质变化不一定都是化学变化,也可能是物理变化,故D错误;
故选C.
点评:本题考查了反应热的影响因素、反应自发进行的条件、反应热的求算、化学反应中的能量变化,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
将等物质的量的金属Na、Mg、Al分别与100mL 2mol/L的盐酸反应,生成气体的体积均为VL(标准状况下),已知:2Na+2H2O=2NaOH+H2,下列说法错误的是( )
| A、反应中,三种金属中有两种金属过量 |
| B、参加反应的金属Na、Mg、Al的物质的量之比为6:3:2 |
| C、镁的物质的量为0.1mol |
| D、V=2.24 |
在2L Fe2(SO4)3和CuSO4的混合溶液中,加入30g纯铁粉,最后得到2L 0.25mol/L的FeSO4溶液和26g固体沉淀物.求原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度.
下列有关实验操作或判断正确的是( )
| A、配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B、需要95 mL 0.1 mol?L-1NaCl溶液,可选用100 mL容量瓶来配制 |
| C、用100 mL的量筒量取5.2 mL的盐酸 |
| D、用托盘天平称取25.20 g NaCl |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、100mL0.1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4 L |
| D、48gO2和O3的混合气体中氧原子数目为3NA |
下列化合物中同分异构体数目最少的是( )
| A、己烷 | B、戊醇 |
| C、戊烯 | D、乙酸乙酯 |
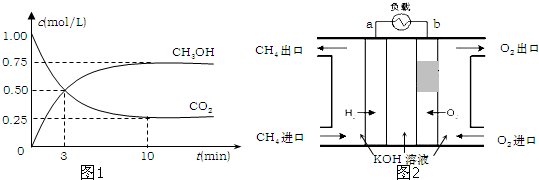

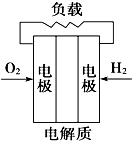
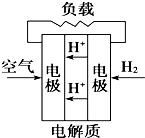
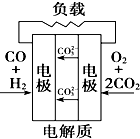
 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.