题目内容
3.下列事实中不能证明CH3COOH是弱电解质的是( )| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
分析 强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,完全电离的电解质是强电解质,要证明醋酸是弱电解质,只要能证明醋酸部分电离即可,据此分析解答.
解答 解:A.0.1mol/L的醋酸pH=2,醋酸中氢离子浓度小于醋酸浓度,则醋酸部分电离,为弱电解质,故A不选;
B.醋酸溶液中含有醋酸分子,说明醋酸部分电离,为弱电解质,故B不选;
C.CH3COOH能与NaOH发生中和反应,说明醋酸具有酸性,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故C选;
D.常温下CH3COONa溶液的pH=8,说明醋酸钠是强碱弱酸盐,则醋酸是弱酸,为弱电解质,故D不选;
故选C.
点评 本题考查强弱电解质判断,为偏高考点,明确强弱电解质根本区别是解本题关键,不能根据电解质溶解性强弱、导电性强弱判断强弱电解质,题目难度不大.

练习册系列答案
相关题目
13.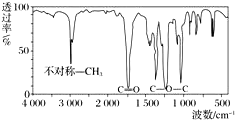 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )| A. | 其化学式为C4H8O2 | |
| B. | 其满足右侧图象的酯有3种 | |
| C. | 鉴定该有机物的结构可用红外光谱或核磁共振氢谱 | |
| D. | 若结构为CH3COOCH2CH3,其核磁共振氢谱中有3个峰 |
14.某同学做完铜、锌原电池的实验后得出了下列结论,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是负极 | |
| C. | 电子沿导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,锌被硫酸溶解,所以才产生电子 |
11.下列说法正确的是( )
| A. | 加水稀释时溶液中各离子浓度均减小 | |
| B. | 加强酸弱酸强碱弱碱均抑制盐类的水解 | |
| C. | 正盐水溶液的pH均为7 | |
| D. | 酸式盐的pH均小于7 |
8.下列做法中利用盐类水解的是( )
| A. | 明矾净水 | B. | 臭氧消毒餐具 | C. | 食醋清洗污垢 | D. | 工厂高压除尘 |
12.某只含酯基的酯类化合物A的化学式为C35H50O6,1mol该酯类化合物A完全水解可得到1mol甘油、2mol不饱和脂肪酸B和1mol直链饱和脂肪酸C.经测定C的相对分子质量为228,则不饱和脂肪酸B的分子式为( )
| A. | C9H10O2 | B. | C9H12O2 | C. | C9H16O2 | D. | C9H18O2 |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1 L 2 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2NA | |
| B. | 2.3 g Na变成Na+时失去的电子数目为0.2NA | |
| C. | 1 mol H2O的质量与NA个H2O的质量之和相等 | |
| D. | 在通常状况下,22.4 L O2与N2的混合物所含分子数为NA |