题目内容
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在1 L 2 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2NA | |
| B. | 2.3 g Na变成Na+时失去的电子数目为0.2NA | |
| C. | 1 mol H2O的质量与NA个H2O的质量之和相等 | |
| D. | 在通常状况下,22.4 L O2与N2的混合物所含分子数为NA |
分析 A.1mol硝酸镁含有2mol硝酸根离子;
B.钠失去1个电子生成+1价钠离子;
C.依据n=$\frac{N}{NA}$计算解答;
D.通常状况下Vm≠22.4L/mol.
解答 解:A.在1 L 2 mol•L-1的硝酸镁溶液中含有硝酸镁物质的量为2mol,含有的硝酸根离子数为4NA,故A错误;
B.每个Na变为Na+都失去1个电子,则0.1 molNa失去的电子数目为0.1NA,故B错误;
C.NA个H2O的物质的量为$\frac{{N}_{A}}{{N}_{A}}$=1mol,所以1 mol H2O的质量与NA个H2O的质量之和相等,故C正确;
D.通常状况下Vm≠22.4L/mol,22.4 L O2与N2的混合物所含分子数不是1mol,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数,掌握以物质的量为核心的计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
3.下列事实中不能证明CH3COOH是弱电解质的是( )
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
1.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):
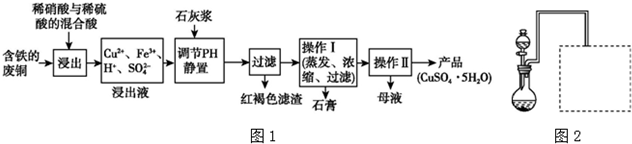
胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
请回答下列问题:①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):

胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
8.配制250 mL 0.10 mol•L-1的NaOH溶液时,下列实验操作会使配制的溶液浓度偏高的是( )
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
3.设NA为阿伏加德罗常数的值,下列关于0.2 mol•L-1Ba(NO3)2溶液的说法不正确的是( )
| A. | 1 L溶液中含Ba2+、N${O}_{3}^{-}$的总数是0.6NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中N${O}_{3}^{-}$的浓度是0.2 mol•L-1 | |
| D. | 1 L溶液中含有0.4NA个N${O}_{3}^{-}$ |
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.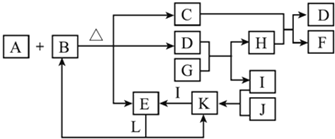
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: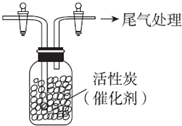 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.