题目内容
12.某只含酯基的酯类化合物A的化学式为C35H50O6,1mol该酯类化合物A完全水解可得到1mol甘油、2mol不饱和脂肪酸B和1mol直链饱和脂肪酸C.经测定C的相对分子质量为228,则不饱和脂肪酸B的分子式为( )| A. | C9H10O2 | B. | C9H12O2 | C. | C9H16O2 | D. | C9H18O2 |
分析 由题目信息可知B、C均为一元羧酸,直链饱和脂肪酸C组成通式符合CnH2nO2,结合相对分子质量确定C的分子式,A的水解可以表示成:C35H50O6+3H2O→C3H8O3(甘油)+C+2B,再根据原子守恒确定B的分子式.
解答 解:只含酯基的酯类化合物A的化学式为C35H50O6,1mol该酯类化合物A完全水解可得到1mol甘油、2mol不饱和脂肪酸B和1mol直链饱和脂肪酸C,则B、C均为一元羧酸,直链饱和脂肪酸C组成通式符合CnH2nO2,其相对分子质量为228,则n=$\frac{228-32}{14}$=14,故C的分子式为C14H28O2,A的水解可以表示成:C35H50O6+3H2O→C3H8O3(甘油)+C14H28O2+2B,根据原子守恒,则B的分子式为C9H10O2,
故选:A.
点评 本题考查有机物分子式确定、酯的水解,关键是理解酯的水解反应、确定C分子式,再利用原子守恒解答.

练习册系列答案
相关题目
2.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
3.下列事实中不能证明CH3COOH是弱电解质的是( )
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
1.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):
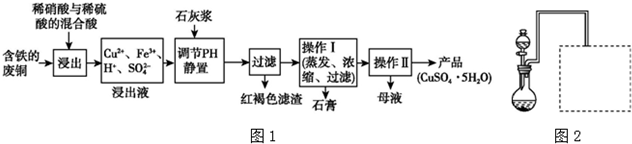
胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
请回答下列问题:①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):

胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
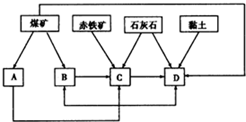 我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.
 .
. 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.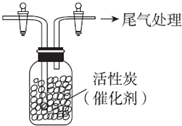 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.