题目内容
18.在含有n mol FeI2的溶液中,通入氯气,有x molCl2发生反应.(1)当x≤$\frac{n}{2}$时,反应的离子方程式为2I-+Cl2=I2+2Cl-.
(2)当反应的离子方程式为:2Fe2++4I-+3Cl2═2Fe3++I2+6Cl-时,x与n的关系是:x≥1.5n.
(3)当Fe2+和I-同时被氧化时,x与n的关系是x>n.
(4)当x=1.25n时,反应后氧化产物的物质的量为1.5nmol.
分析 (1)根据得失电子守恒,当x=n时碘离子恰好完全被氧化,生成碘单质,而x≤$\frac{n}{2}$时,碘离子只有极少部分被氧化;
(2)向FeI2溶液中通入氯气,氯气先和碘离子发生置换反应,然后再和亚铁离子发生反应,根据氯气和FeI2反应的离子方程式确定x与n的关系;
(2)n molFeI2的溶液中通入Cl2,有x molCl2发生反应,当x≤n时,氯气只能氧化碘离子;
(3)氯气先和碘离子发生置换反应,然后再和亚铁离子发生反应,所以当Fe2+和I-两种离子-同时被氧化时,x>n;
(4)当x=n时,只能氧化碘离子,根据2I-+Cl2=2Cl-+I2方程式计算可解.
解答 解:向FeI2溶液中通入氯气,氯气先和碘离子发生置换反应2I-+Cl2=2Cl-+I2,然后再和亚铁离子发生反应2Fe2++Cl2=Fe3++2Cl-;所以在含有n molFeI2的溶液中通入Cl2,有x molCl2发生反应,
当$\frac{x}{n}$≥$\frac{3}{2}$时,碘离子、二价铁离子全部被氧化;$\frac{x}{n}$≤1时,只能氧化碘离子;1<$\frac{x}{n}$<$\frac{3}{2}$时,既氧化全部碘离子,又氧化部分二价铁离子.
(1)根据得失电子守恒,当x=n时碘离子恰好完全被氧化,生成碘单质,而x≤$\frac{n}{2}$时,碘离子只有极少部分被氧化,所以反应的离子方程式为:2I-+Cl2=I2+2Cl-,故答案为:2I-+Cl2=I2+2Cl-;
(2)当反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-时,由方程式可知:当参加反应的FeI2为2mol时,通入的氯气为3mol,此时碘离子、二价铁离子全部被氧化,氯气可以过量,所以,在含有n molFeI2的溶液中通入x molCl2,x与n的关系为$\frac{x}{n}$≥$\frac{3}{2}$,即x≥1.5n,
故答案为:x≥1.5n;
(3)当Fe2+和I-两种离子-同时被氧化时,反应中先氧化全部碘离子,然后剩余的氯气再氧化二价铁离子,x>n,
故答案为:x>n;
(4)x=1.25n时,2nmol的I-全部被氧化,0.25×2mol的Fe2+被氧化,所以氧化产物为nmolI2和0.5mol的Fe3+,所以氧化产物一共1.5nmol,故答案为:1.5nmol.
点评 本题以氯气和碘化亚铁的反应为载体考查了氧化还原反应,明确溶液中离子反应的先后顺序是解本题的关键,采用极值讨论法来分析解答较简便,题目难度中等.

 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
| A. | 可加入烧碱溶液以提高电池的性能,碱性电池的能量和可储存时间均较高 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量减少 | |
| D. | 放电时电池正极反应为:FePO4+Li+-e-═LiFePO4 |
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
| A. | 100℃下水的电离程度较大 | B. | 前者的C(H+)较后者小 | ||
| C. | 水的电离过程是一个放热过程 | D. | 温度越高,Kw越大 |
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.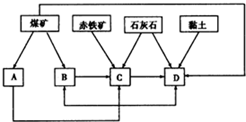 我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.