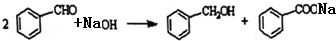
题目内容
11.下列说法正确的是( )| A. | 加水稀释时溶液中各离子浓度均减小 | |
| B. | 加强酸弱酸强碱弱碱均抑制盐类的水解 | |
| C. | 正盐水溶液的pH均为7 | |
| D. | 酸式盐的pH均小于7 |
分析 A.稀释过程中水的离子积不变,稀释过程中若氢离子浓度减小,则氢氧根离子浓度会增大;
B.酸电离出的氢离子、碱电离出的氢氧根离子都抑制了盐的水解,如醋酸钠溶液中,加入氢氧化钠,氢氧根离子浓度增大,抑制了醋酸根离子的水解,加入酸生成醋酸,醋酸浓度增大,也抑制了醋酸钠的水解;
C.正盐的水溶液不一定为7,如碳酸钠、亚硫酸钠溶液;
D.酸式盐的溶液的pH不一定小于7,如碳酸氢钠为酸式盐,其溶液为碱性.
解答 解:A.加水稀释时溶液中各离子浓度不一定均减小,如:酸性溶液中,稀释过程中氢离子浓度减小,而水的离子积不变,则溶液中的氢氧根离子浓度增大,故A错误;
B.加入强酸、弱酸、强碱、弱碱,酸中氢离子、碱溶液中的氢氧根离子均抑制盐类的水解,如醋酸钠溶液中加入氢氧化钠或盐酸,都抑制了醋酸钠的水解,故B正确;
C.正盐的水溶液的pH不一定等于7,如碳酸钠为正盐,碳酸钠溶液呈碱性,故C错误;
D.酸式盐的水溶液的pH不一定小于7,如碳酸氢钠为酸式盐,碳酸氢钠溶液中,碳酸氢根离子部分水解,溶液呈碱性,溶液的pH大于7,故D错误;
故选B.
点评 本题考查了盐的水解原理及其应用,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
1.11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4 反应中,1mol Cu2+能氧化 P 的物质 的量是( )
| A. | $\frac{2}{5}$ mol | B. | $\frac{11}{5}$ mol | C. | $\frac{1}{5}$ mol | D. | $\frac{1}{3}$ mol |
2.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
19.用质量均为100g的Cu作电极,电解AgNO3溶液.稍电解一段时间后,两电极的质量相差14g,此时两电极的质量分别为( )
| A. | 阳极100g,阴极128g | B. | 阳极96.8g,阴极110.8g | ||
| C. | 阳极94.8g,阴极108.8g | D. | 阳极95.9g,阴极114.0g |
6.发生在美国的墨西哥湾原油泄漏事件极大地破坏了生态环境,该事件警示人类应合理的开发和利用能源.随着经济的飞速发展,机动车越来越多,对石油产品的需求激增,为了环保和降低成本,很多国家转型研究电动车.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质,电池反应为:FePO4+Li$?_{充电}^{放点}$LiFePO4.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入烧碱溶液以提高电池的性能,碱性电池的能量和可储存时间均较高 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量减少 | |
| D. | 放电时电池正极反应为:FePO4+Li+-e-═LiFePO4 |
3.下列事实中不能证明CH3COOH是弱电解质的是( )
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
1.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):
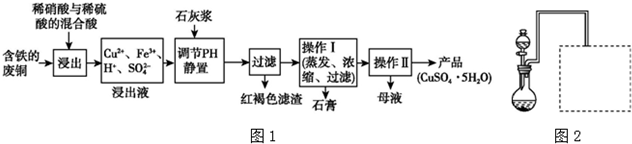
胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
请回答下列问题:①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):

胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).