题目内容
12.工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下: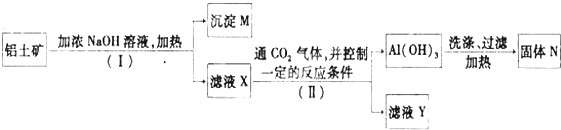
(1)沉淀M中除含有泥沙外,一定还含有Fe2O3,
(2)滤液X中,含铝元素的溶质的化学式为Na[Al(OH)4];写出Ⅰ过程生成含铝元素的溶质的化学方程式:Al2O3+2NaOH+3H2O=2Na[Al(OH)4];
(3)固体N是Al2O3;写出A1(OH)3转化为N的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 铝土矿中含有A12O3、Fe2O3、SiO2等,NaOH和A12O3、SiO2反应生成可溶性盐,Fe2O3不溶于NaOH,所以M的成分主要是Fe2O3,滤液中的成分为Na2SiO3、NaAlO2,向滤液X中通入二氧化碳,并控制一定反应条件,得到Al(OH)3,滤液Y中含有碳酸氢钠、硅酸钠,Al(OH)3加热分解生成氧化铝,所以N的成分是A12O3,以此解答该题.
解答 解:铝土矿中含有A12O3、Fe2O3、SiO2等,NaOH和A12O3、SiO2反应生成可溶性盐,Fe2O3不溶于NaOH,所以M的成分主要是Fe2O3,滤液中的成分为Na2SiO3、NaAlO2,向滤液X中通入二氧化碳,并控制一定反应条件,得到Al(OH)3,滤液Y中含有碳酸氢钠、硅酸钠,Al(OH)3加热分解生成氧化铝,所以N的成分是A12O3,
(1)因Fe2O3与氢氧化钠不反应,则沉淀M中除含有泥沙外,一定还含有Fe2O3,故答案为:Fe2O3;
(2)滤液X中,含铝元素的溶质是偏铝酸钠,化学式为Na[Al(OH)4],与氧化铝与氢氧化钠反应生成,方程式为Al2O3+2NaOH+3H2O=2Na[Al(OH)4],
故答案为:Na[Al(OH)4];Al2O3+2NaOH+3H2O=2Na[Al(OH)4];
(3)氢氧化铝受热易分解生成氧化铝和水,所以固体N是Al2O3,方程式为2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3;2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题以铝为载体考查了工艺流程,明确物质的性质是解本题关键,根据物质间的反应来分析解答,会从整体上分析问题,并迁移基础知识解答,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案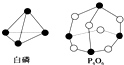 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )| A. | 放热1638 kJ | B. | 吸热1638 kJ | C. | 吸热3276 kJ | D. | 放热3276 kJ |
| 实验目的 | 实验步骤 | |
| A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加BaCl2溶液,观察是否生成沉淀 |
| B | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
| C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| D | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉看粉末是否变红 |
| A. | A | B. | B | C. | C | D. | D |
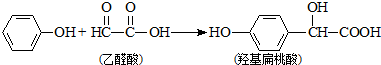
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
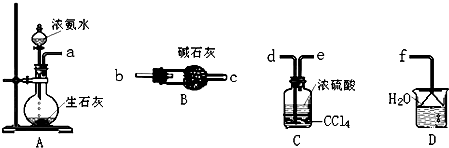
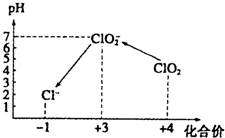 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.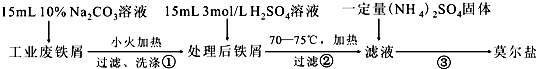


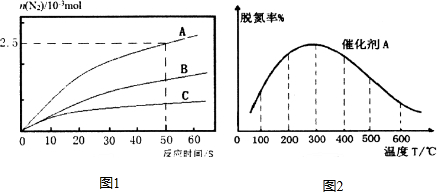 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.