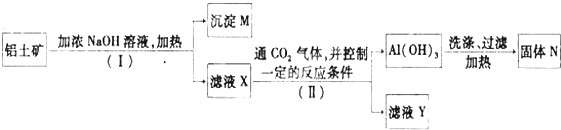
题目内容
20.在一定温度下,向一个5L的密闭容器中通入2mol N2和8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1,平衡时容器内气体压强为起始时的80%.计算平衡时容器内NH3的体积分数为25%.
分析 设平衡时参加反应N2的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,利用压强之比等于物质的量之比,结合平衡时容器内气体压强为起始时的80%列方程计算x的值,进而计算氨气的体积分数.
解答 解:设平衡时参加反应N2的物质的量为xmol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):2 8 0
变化(mol):x 3x 2x
平衡(mol):2-x 8-3x 2x
则:2-x+8-3x+2x)=(2+8)×80%,
解得:x=1,
所以平衡时容器内NH3的体积分数为:$\frac{2mol}{10mol×80%}$×100%=25%,
故答案为:25%.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.在3NO2+H2O=2HNO3+NO反应中,氧化剂与还原剂的分子数为( )
| A. | 1:2 | B. | 3:1 | C. | 1:1 | D. | 1:3 |
8.下列有关化学用语的说法不正确的是( )
| A. | -OH与 都表示羟基 都表示羟基 | B. | 如图是食盐晶体的晶胞 | ||
| C. | CH4分子的球棍模型: | D. | 次氯酸分子的电子式: |
15.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 2-乙基丁烷 | B. | 二溴乙烷 | C. | 2-甲基丁烯 | D. | 苯甲醇 |
5.向含有0.20mol碳酸钠的溶液中逐滴滴入200mL1.5mol/L的盐酸,充分反应后,将所产生的气体收集起来,测得标况下体积为( )
| A. | 3.36L | B. | 1.12L | C. | 2.24L | D. | 4.48L |
9.下列图示与对应的叙述相符的是( )
| A. |  表示某吸热反应分别在有、无催化剂的情况况下反应过程中的能量变化 | |
| B. |  表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH溶液体积的关系,则三种离子的物质的量之比比为(Mg2+):(Al3+):n(NH4+)=2:3:2 | |
| C. | 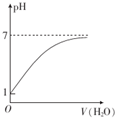 表示常温下0.10 mol•L-1的CH3COOH溶液加水稀释时溶液的pH变化 | |
| D. |  表示向10.00 mL 0.050 mol•L-1盐酸中逐滴加人0.025 mol•L-1的氨水时溶液的pH变化,其中 V1>20.00 |
10.某的化合物化学式为:K3[Fe(C2O4)3],下列有关说法正确的是( )
| A. | 铁元素的化合价是+3 | |
| B. | 铁离子的配位数是3 | |
| C. | C2O42-中碳原子的杂化方式为sp3 | |
| D. | 该物质中含有离子键,配位键和极性共价键 |