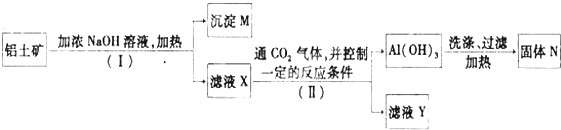
题目内容
1. 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.已知:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1
②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1
③4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3
(1)对于反应③,△H3=-1811.63KJ/mol,△S=>0(填>、<或=),在任意温度下发生自发反应(选填”较低温度“、“较高温度”或“任意温度”).
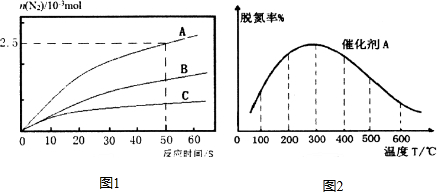
(2)利用反应③消除氮氧化物的污染,相同条件下,在2L恒容密闭容器中,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示.
①0~50s在A催化剂作用下,反应速率v(N2)=6.25×10-2mol•L-1•s-1.
②下列说法正确的是CD
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达到平衡时,N2最终产率更大
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)在氨气足量时,反应③在催化剂A作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小,其可能的原因是300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小.(已知A、B催化剂在此温度范围内不失效)
(4)其他条件相同时,请在图2中补充在催化剂B作用下脱氮率随温度变化的曲线.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;反应自发进行的判断依据是△H-T△S<0,依据判断依据分析;
(2)①根据v=$\frac{△c}{△t}$,进行计算求解;
②A.反应速率越快活化能越小,该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C);
B.使用催化剂平衡不移动,N2最终产率相同;
C.反应前后H-O键与N-H键的数目相等,所以单位时间内H-O键与N-H键断裂的数目相等时,说明正逆反应速率相等,反应已经达到平衡;
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明温度不变,反应已经达到平衡;
(3)由图可知300℃以前温度越高脱氮率越高,300℃后温度越高脱氮率越低;
(4)B催化剂的效率低,所以达平衡的时间长,平衡不移动,但最终的脱氮率不变,由此作图.
解答 解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1
②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1
③4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=$\frac{5×②-3×①}{2}$=$\frac{5×(-1269.02)-3×(-907.28)}{2}$=-1811.63KJ/mol;4NH3(g)+6NO(g)═5N2(g)+6H2O(g)气体的物质的量增加,所以△S>0,△H<0、△S>0,△H-T△S<0,反应一定能自发进行,
故答案为:-1811.63KJ/mol;>;任意温度;
(2)①v(N2)=$\frac{△c}{△t}$=$\frac{2.5×1{0}^{-3}}{\frac{2}{50}}$=6.25×10-2mol•L-1•s-1,故答案为:6.25×10-2mol•L-1•s-1;
②A.反应速率越快活化能越小,该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故错误;
B.使用催化剂平衡不移动,N2最终产率相同,故错误;
C.反应前后H-O键与N-H键的数目相等,所以单位时间内H-O键与N-H键断裂的数目相等时,说明正逆反应速率相等,反应已经达到平衡,故正确;
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明温度不变,反应已经达到平衡,故正确;
故选CD;
(3)由图可知300℃以前温度越高脱氮率越高,300℃后温度越高脱氮率越低,原因可能是300℃前是平衡的建立过程,而300℃后是平衡的移动,
故答案为:300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小;300℃前反应未平衡,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小;
(4)B催化剂的效率低,所以达平衡的时间长,平衡不移动,但最终的脱氮率不变,所以图象为 ,
,
故答案为: .
.
点评 本题考查较综合,涉及图象分析、盖斯定律、化学平衡移动的知识等,注意图象分析中的曲线的变化趋势,题目难度中等.

| A. | 1:2 | B. | 3:1 | C. | 1:1 | D. | 1:3 |
| A. |  表示某吸热反应分别在有、无催化剂的情况况下反应过程中的能量变化 | |
| B. |  表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH溶液体积的关系,则三种离子的物质的量之比比为(Mg2+):(Al3+):n(NH4+)=2:3:2 | |
| C. | 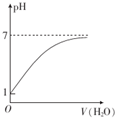 表示常温下0.10 mol•L-1的CH3COOH溶液加水稀释时溶液的pH变化 | |
| D. |  表示向10.00 mL 0.050 mol•L-1盐酸中逐滴加人0.025 mol•L-1的氨水时溶液的pH变化,其中 V1>20.00 |
| A. | 甲烷的熔沸点比硅烷的低 | |
| B. | NH3易液化 | |
| C. | NH3分子比PH3分子稳定 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
| A. | H-F | B. | H-O | C. | H-N | D. | H-C |
| A. | 铁元素的化合价是+3 | |
| B. | 铁离子的配位数是3 | |
| C. | C2O42-中碳原子的杂化方式为sp3 | |
| D. | 该物质中含有离子键,配位键和极性共价键 |
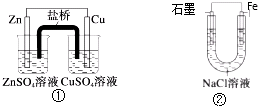
| A. | 装置②中的Fe发生析氢腐蚀 | |
| B. | 装置①中,Zn为负极,发生还原反应 | |
| C. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| D. | 装置②中电子由Fe流向石墨,然后再经溶液流向Fe |