题目内容
3. ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有氧化性.
(2)工业上可用Cl2氧化NaClO2溶液制取ClO2,该反应的化学方程式为Cl2 +2NaClO2 =2NaCl+2ClO2.工业上还可在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,NaClO3在(填阴或阳)阳极生成,生成ClO3-的电极反应式为Cl--6e-+3 H2O=6H++ClO3-.
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32-+I2═+2I-)
Ⅲ.加硫酸调节水样pH至1~3.
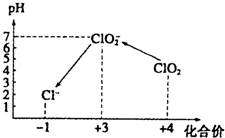
操作时,不同pH环境中粒子种类如右图所示.
①操作工中反应的离子方程式是2ClO2+2I-=2ClO2-+I2.
②确定操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色.
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是0.675mg/L.
分析 (1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低;
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,结合原则守恒和电子守恒写出该反应的化学方程,工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,氯离子失电子在阳极生成氯酸根离子;
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性,
故答案为:氧化;
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,结合原则守恒和电子守恒写出该反应的化学方程Cl2+2NaClO2=2NaCl+2ClO2,工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,氯离子失电子在阳极生成氯酸根离子,电极反应为:Cl--6e-+3 H2O=6H++ClO3-,
故答案为:Cl2+2NaClO2=2NaCl+2ClO2;阳; Cl--6e-+3 H2O=6H++ClO3-;
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,故答案为:2ClO2+2I-=2ClO2-+I2.
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~~~~I-~~~ClO2
1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1
故答案为:0.675.
点评 本题考查了物质含量的测定、氧化还原反应、离子方程式的书写、有关方程式的计算,题目综合性较强,侧重于考查学生对基础知识的综合应用能力和计算能力,题目难度中等,注意把握物质含量的测定方法.

| A. | 1:2 | B. | 3:1 | C. | 1:1 | D. | 1:3 |
①甲单质比乙单质容易与氢气化合
②甲元素的单质能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物的酸性强
④与某金属反应时,甲比乙得电子数多
⑤甲的单质熔沸点比乙的单质低.
| A. | 只有③④ | B. | 只有①②⑤ | C. | 只有①②③ | D. | ①②③④⑤ |
| A. | -OH与 都表示羟基 都表示羟基 | B. | 如图是食盐晶体的晶胞 | ||
| C. | CH4分子的球棍模型: | D. | 次氯酸分子的电子式: |
| A. | 2-乙基丁烷 | B. | 二溴乙烷 | C. | 2-甲基丁烯 | D. | 苯甲醇 |
| A. | H-F | B. | H-O | C. | H-N | D. | H-C |




 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.