题目内容
2.W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍.下列说法正确的是( )| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |
分析 W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍,W应该位于第一周期第IA族,为H元素,则Z为Na元素,X和Y最外层电子数之和为12,则X为N元素、Y为F元素,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.元素的金属性越强,其原子失电子能力越强;
D.非金属元素之间易形成共价键,只含共价键的化合物是共价化合物.
解答 解:W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍,W应该位于第一周期第IA族,为H元素,则Z为Na元素,X和Y最外层电子数之和为12,则X为N元素、Y为F元素,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小,F-、Na+电子层结构相同,且原子序数F<Na,所以离子半径Y>Z,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Y>X,所以氢化物的稳定性X<Y,故B错误;
C.元素的金属性越强,其原子失电子能力越强,Z是金属元素、W是非金属元素,所以失电子能力Z>W,故C正确;
D.非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,X是N、Y是F元素,二者形成的化合物中只含共价键,为共价化合物,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析推断能力,明确原子结构、元素周期表结构、元素周期律、物质结构是解本题关键,知道离子半径大小比较方法,题目难度不大.

练习册系列答案
相关题目
13.X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元 素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法错误的是( )
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | 化合物乙中一定只含共价键 | |
| C. | W和Z元素形成的化合物中只含极性键 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
10.下列图示实验正确的是( )
| A. | 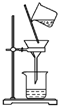 除去粗盐溶液中的不溶物 | B. | 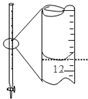 记录滴定终点读数为12.20ml | ||
| C. | 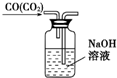 除去CO气体中的CO2气体 | D. | 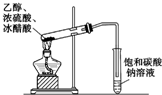 乙酸乙酯制备演示实验 |
17.青蒿素结构式如图所示.下列有关青蒿素的说法错误的是( )
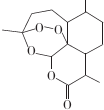

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可发生取代反应 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
7.短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 标准状况下的2.24 LM溶于水,所得溶液pH=13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | 一定条件下,Cu可与W的最高价氧化物对应水化物发生反应 |
11.2.3g某有机物A完全燃烧只生成CO2和水蒸气,生成的气体若通过盛有浓硫酸的洗气瓶后,洗气瓶增重2.7g,若通过装有碱大石灰的干燥管,干燥管增重7.1g.有机物的分子为( )
| A. | C4H12O2 | B. | C3H8O | C. | C2H6O | D. | C2H4 |
12.常温下,将3.9gNa2O2粉末投入水中,充分反应.关于此过程说法正确的是(NA表示阿伏伽德罗常数)( )
| A. | 生成气体体积为560mL | B. | 反应中电子转移数目为0.1NA | ||
| C. | Na2O2粉末中含离子数目为0.15NA | D. | 所得溶液pH为13 |