题目内容
17.青蒿素结构式如图所示.下列有关青蒿素的说法错误的是( )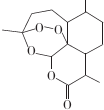
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可发生取代反应 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
分析 由结构筒式可知,分子中含5个环状结构,含-COOC-及1个过氧基团,结合酯的性质解答该题.
解答 解:由结构简式可知青蒿素的分子式为C15H22O5,故A正确;
B.含有过氧键,不稳定,在温度过高时可分解而变质,故B错误;
C.含有酯基,可发生水解反应,为取代反应,故C正确;
D.没有羟基、羧基等亲水基,难溶于水,易溶于有机溶剂,可萃取后蒸馏,故D正确.
故选B.
点评 本题考查有机物的结构性质,为高频考点,把握结构中的环状及酯的性质为解答的关键,侧重分析能力和知识迁移应用能力的考查,注意有机物分子式由结构中化学键分析,题目难度中等.

练习册系列答案
相关题目
7.下列实验的有关叙述错误的是( )
| 选项 | A | B | C | D |
| 实验装置图 |  | 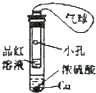 |  | 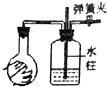 |
| 实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
| 实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
8.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:
(1)能形成共价键的元素有H、He、C、N、O、F、S、Cl元素,共8种.
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.
5.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA | |
| C. | 常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA | |
| D. | 在1 L 1.0 mol•L-1碳酸钠溶液中,阴离子总数大于NA |
12. 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
| A. | 在400℃时,反应①未达平衡,反应②达到平衡 | |
| B. | 800℃后再升高温度,反应①的平衡逆向移动;反应②的平衡正向移动 | |
| C. | 加压可提高NH3生成NO的转化率 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=-181.5 kJ•mol-1 |
2.W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍.下列说法正确的是( )
| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |
6.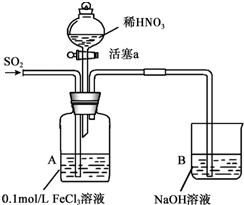 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如下:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如下:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O
 Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2
 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
7.下列过程中颜色变化叙述正确的是( )
| A. | 湿润淀粉碘化钾试纸遇NO2变蓝 | B. | 溴化银见光分解变白 | ||
| C. | 热的氧化铜遇乙醇变绿 | D. | 苯酚遇石蕊试液变红 |

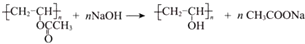
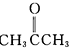 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是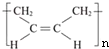 .
.