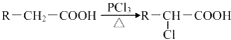题目内容
11.2.3g某有机物A完全燃烧只生成CO2和水蒸气,生成的气体若通过盛有浓硫酸的洗气瓶后,洗气瓶增重2.7g,若通过装有碱大石灰的干燥管,干燥管增重7.1g.有机物的分子为( )| A. | C4H12O2 | B. | C3H8O | C. | C2H6O | D. | C2H4 |
分析 生成的气体依次通过盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,浓硫酸吸收水,根据质量可知烃中H元素的质量,盛有碱石灰的干燥管吸收二氧化碳和水,根据质量可知有机物中C元素的质量,再根据质量守恒计算出2.3g该有机物分子中含有的氧元素的质量,最后根据物质的量计算出其分子最简式结合选项即可解答.
解答 解:生成的气体依次通过盛有浓硫酸的洗气瓶,浓硫酸吸收水,
则n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则n(H)=0.15×2=0.3mol;m(H)=0.3g
盛有碱石灰的干燥管吸收二氧化碳和水,吸收的二氧化碳的质量为7.1g-2.7g=4.4g,
则n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则n(C)=0.1mol,m(C)=1.2g,
n(O)=$\frac{2.3g-0.3g-1.2g}{16g/mol}$=0.05mol,
则n(C):n(H):n(O)=0.1:0.3:0.05=2:6:1,满足条件的为AC,有机物的分子式为:C4H12O2、C2H6O,
故选AC.
点评 本题综合考查有机物分子式的确定以及有机物结构的推导,题目难度不大,注意掌握确定有机物分子式的方法.

练习册系列答案
相关题目
1.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
2.W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍.下列说法正确的是( )
| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |
19.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 密度:Na>K | B. | 稳定性:HCl>HBr | C. | 还原性:I?>Br? | D. | 碱性:KOH>NaOH |
6.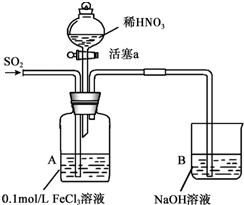 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如下:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如下:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O
 Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2
 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
16.化学与生产、生活、环境等社会实际密切相关.下列叙述错误的是( )
| A. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| B. | 垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 | |
| C. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |
3.关于阿司匹林,下列说法正确的是( )


| A. | 不能用FeCl3 溶液鉴别水杨酸和阿司匹林 | |
| B. | 服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液 | |
| C. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| D. | 该反应不属于取代反应 |
1.25℃时,用0.1mol•L-1的NaOH溶液滴定0.1mol•L-1CH3COOH(Ka=1.75×10-5)溶液过程中,消耗NaOH溶液的体积与溶液pH的关系如图所示,下列各项中微粒浓度间关系正确的是( )

| A. | 点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |