题目内容
12.利用周期表中同族元素的相似性,可预测元素的性质.(1)P元素的基态原子有3个未成对电子,白磷的分子式为P4,其结构如图1所示.
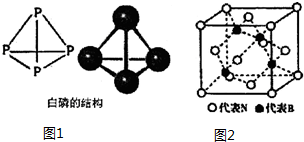
科学家目前合成了N4分子,N原子的杂化轨道类型是sp3,N-N键的键角为60°;N4分解后能产生N2并释放出大量能量,推测其用途为制造火箭推进剂或炸药.
(2)N、P、As原子的第一电离能由大到小的顺序为N>P>As.
(3)立方氮化硼晶体的结构如图2所示:
该晶体中,B原子填充在N原子的正四面体空隙,且占据此类空隙的比例为50% (填百分数).
(4)N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是氮化硼;立方砷化镓晶体的晶胞边长为a pm,则其密度为$\frac{5.8×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值).
分析 (1)P元素原子价电子排布式为3s22p3;N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,每个面为正三角形;N4分解后能产生N2并释放出大量能量,可以制造火箭推进剂或炸药;
(2)同主族自上而下第一电离能减小;
(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子;
(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径越小,共价键越强,晶体熔点越高;根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)P元素原子价电子排布式为3s22p3,基态原子有3个未成对电子,N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N-N 键的键角为60°;N4分解后能产生N2并释放出大量能量,可以制造火箭推进剂或炸药,
故答案为:3;sp3;60°;制造火箭推进剂或炸药;
(2)同主族自上而下第一电离能减小,故第一电离能:N>P>As,
故答案为:N>P>As;
(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子,B原子占据此类空隙的比例为50%,
故答案为:正四面体;50%;
(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径N<As、B<Ga,故氮化硼中共价键更强,氮化硼的晶体熔点更高,晶胞中As、Ga原子数目均为4,晶胞质量为4×$\frac{145}{{N}_{A}}$g,晶胞密度为4×$\frac{145}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{5.8×1{0}^{32}}{{N}_{A}•{a}^{3}}$g.cm-3,
故答案为:氮化硼; $\frac{5.8×1{0}^{32}}{{N}_{A}•{a}^{3}}$.
点评 本题考查晶胞的计算,题目难度中等,涉及核外电子排布、杂化方式判断、分子结构、电离能、晶胞结构与计算、熔沸点比较等知识,(3)为易错点、难点,需要学生具备一定的空间想象,注意同周期元素第一电离能异常情况,试题培养了学生的分析能力及灵活应用能力.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案 一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T温度下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T温度下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H>0 |
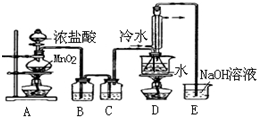 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:①CS2+3Cl2$\stackrel{50-60℃}{→}$CCl4+S2Cl2;
②2S+Cl2$\stackrel{90-100℃}{→}$S2Cl2.
已知S2Cl2中硫元素显+1价,S2Cl2不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).
反应涉及的几种物质的熔沸点如表:
实验室利用下列装置通过方法①来制备S2Cl2(部分夹持仪器已略去).回答下列问题:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
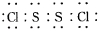 .
.(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(4)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中BC实验.
A.银镜反应 B.制取乙酸乙酯 C.制取溴苯 D.制备乙烯
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清且生成两种有刺激性气味的气体,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的浓氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
| 选项 | A | B | C | D |
| 实验装置图 |  | 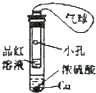 |  | 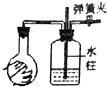 |
| 实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
| 实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |