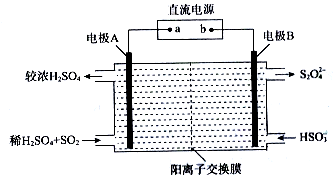
题目内容
5.下列化学用语正确的是( )| A. | 氮分子的结构式  | B. | 硫原子的结构示意图 | ||
| C. | 氯化钠的电子式 | D. | 水分子的结构式 H-O-H |
分析 A.结构式中不需要标出未成键电子对;
B.硫原子核电荷数=核外电子总数=16,最外层含有6个电子;
C.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.水为共价化合物,分子中含有2个O-H键,用短线代替所有的共用电子对较为结构式.
解答 解:A.氮气分子中含有1个氮氮三键,其正确的结构式为N≡N,故A错误;
B. 为氯离子结构示意图,硫原子的核电荷数为16,最外层含有6个电子,硫原子正确的原子结构示意图为:
为氯离子结构示意图,硫原子的核电荷数为16,最外层含有6个电子,硫原子正确的原子结构示意图为: ,故B错误;
,故B错误;
C.氯化钠是由钠离子和氯离子构成的,其正确的电子式为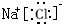 ,故C错误;
,故C错误;
D.水分子中含有2个O-H键,其结构式为:H-O-H,故D正确;
故选D.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、结构式、原子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列电极反应式与出现的环境相匹配的是( )
| 选项 | 电极反应式 | 出现的环境 |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | Cu-2e-═Cu2+ | 用铜做电极电解NaOH溶液的阳极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
16.下列叙述或事实,能用勒夏特列原理解释的是( )
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
13.一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,反应达到平衡状态,这说明( )
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
10.在含有大量H+、Ca2+、Cl-的溶液中,还能大量共存的离子是 ( )
| A. | OH- | B. | NO3- | C. | CO32- | D. | Ag + |
17.下列化学用语表述正确的是( )
| A. | 氯气的电子式: | B. | 氮气的结构式: | ||
| C. | F一的结构示意图: | D. | H2O2的电子式: |
14.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p4.则下列有关比较中正确的是( )
| A. | 电负性:④>③>②>① | B. | 原子半径:④>③>②>① | ||
| C. | 第一电离能:④>③>②>① | D. | 最高正化合价:④>③>②>① |