题目内容
10.在含有大量H+、Ca2+、Cl-的溶液中,还能大量共存的离子是 ( )| A. | OH- | B. | NO3- | C. | CO32- | D. | Ag + |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:A.H+、Ca2+均与OH-不能大量共存,分别结合生成水、沉淀,故A不选;
B.均与硝酸根离子不反应,可大量共存,故B选;
C.H+、Ca2+均与CO32-不能共存,分别结合生成水和气体、沉淀,故C不选;
D.Cl-、Ag +结合生成沉淀,不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
20.某工业废水中仅含表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为0.045mol/L(精确到千分位).
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为CuO和Fe2O3质量为1.6g.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为0.045mol/L(精确到千分位).
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为CuO和Fe2O3质量为1.6g.
18.下列关于浓硫酸和稀硫酸的叙述中错误的是( )
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
5.下列化学用语正确的是( )
| A. | 氮分子的结构式  | B. | 硫原子的结构示意图 | ||
| C. | 氯化钠的电子式 | D. | 水分子的结构式 H-O-H |
2.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
19.溶液中可能大量存在的一组离子是( )
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
19.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究.
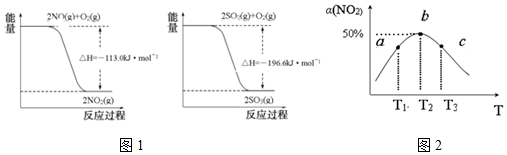
(1)已知:写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol.
(2)向容积为1L密闭容器中分别充入0.10mol NO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图1所示.
①如图2a、c两点反应速率大小关系:υ(a)<υ(c).(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为0.025mol•L-1•min-1,此温度下该反应的平衡常数为0.5,若在此温度下,保持容器的容积不变,再向容器中充入0.20mol NO2和0.30mol SO2,NO2的转化率不变.(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小.
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如表:
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式2HSO3-+2H++2e-=S2O42-+2H2O.

(1)已知:写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol.
(2)向容积为1L密闭容器中分别充入0.10mol NO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图1所示.
①如图2a、c两点反应速率大小关系:υ(a)<υ(c).(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为0.025mol•L-1•min-1,此温度下该反应的平衡常数为0.5,若在此温度下,保持容器的容积不变,再向容器中充入0.20mol NO2和0.30mol SO2,NO2的转化率不变.(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小.
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式2HSO3-+2H++2e-=S2O42-+2H2O.

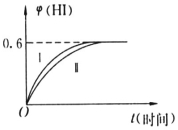 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).