题目内容
17.下列化学用语表述正确的是( )| A. | 氯气的电子式: | B. | 氮气的结构式: | ||
| C. | F一的结构示意图: | D. | H2O2的电子式: |
分析 A.氯气的电子式中漏掉了Cl原子的3对未成键电子对;
B.氮气的结构式中不需要标出未成键电子对;
C.氟离子的核电荷数为9,最外层达到8电子稳定结构;
D.双氧水为共价化合物,分子中不存在阴阳离子.
解答 解:A.氯气分子中含有1个Cl-Cl键,硫原子最外层达到8电子稳定结构,氯气正确的电子式为 ,故B错误故A错误;
,故B错误故A错误;
B.氮气分子中含有氮氮三键,其正确的结构式为N≡N,故B错误;
C.氟离子核外电子总数为10,其离子结构示意图为: ,故C正确;
,故C正确;
D.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水正确的电子式为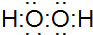 ,故D错误;
,故D错误;
故选C.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、原子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
相关题目
8.下列各装置能够达到相应实验目的是( )
| A. | 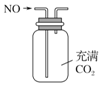 用图所示装置(正放)可收集NO气体 | |
| B. | 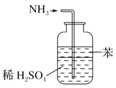 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 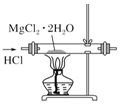 用装置制取无水MgCl2 | |
| D. |  用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
5.下列化学用语正确的是( )
| A. | 氮分子的结构式  | B. | 硫原子的结构示意图 | ||
| C. | 氯化钠的电子式 | D. | 水分子的结构式 H-O-H |
12.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向硝酸溶液中加入碳酸钠,有大量气泡产生 | 酸性:碳酸>硝酸 |
| B | 向1mL 某溶液中,滴入2mL 0.1mol•L-1 NaOH溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 | 某溶液中含NH4+ |
| C | 取5mL 0.1mol•L-1FeCl3溶液,滴加5滴0.1mol•L-1KI溶液,振荡,再加入5mL CCl4,振荡,静置,取上层液体,向取出来的溶液中滴加KSCN溶液,显血红色. | KI和FeCl3反应有一定的限度 |
| D | 加热使冰化成液态水 | 分子内H-O键发生断裂 |
| A. | A | B. | B | C. | C | D. | D |
2.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
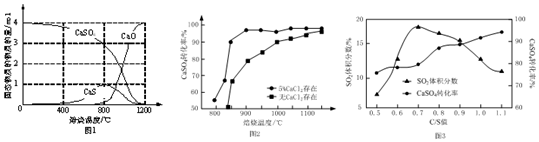
 .
.