题目内容
13.一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,反应达到平衡状态,这说明( )| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
分析 一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,各物质的浓度保持不变说明反应达到平衡状态,正逆反应速率相同,各组分含量保持不变.
解答 解:一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,各物质的浓度保持不变说明反应达到平衡状态,
A.化学平衡是动态平衡,反应只是正逆反应速率相同,反应未停止,故A错误;
B.浓度不变说明反应达到平衡状态,故B正确;
C.反应是可逆反应不能进行彻底,故C错误;
D.达到平衡状态正逆反应速率相同,故D错误;
故选B.
点评 本题考查了化学反应达到平衡状态的标志,注意平衡状态正逆反应速率相同,各组分含量保持不变,是动态平衡,题目难度不大.

练习册系列答案
相关题目
3.硫化钠(Na2S)在工业上用途广泛.某课题组用无水Na2SO4制备硫化钠的流程如下:
①取一定量的无水Na2SO4和碳粉进行隔绝空气高温灼烧;
②将灼烧产物冷却后,加入NaOH溶液进行碱浸
③过滤,滤液经过一系列的操作步骤后得到硫化钠晶体.
(1)过滤需要用到的主要玻璃仪器是漏斗、烧杯、玻璃棒.
(2)若灼烧所得气体为等物质的量的CO和CO2,写出灼烧时发生的化学反应方程为3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑.
(3)上述流程中采用a浸洗更好.
a.稀NaOH溶液b.热水c.氨水d.乙醇
(4)固体产物Na2S晶体中可能含有杂质,该课题组对固体产物的杂质成分提出以下假设:
假设一:杂质成分为NaOH;
假设二:杂质成分为Na2SO4;
假设三:杂质成分为NaOH和Na2SO4.
为验证假设三成立,课题组进行如下研究,请你完成下表中的内容:
:
①取一定量的无水Na2SO4和碳粉进行隔绝空气高温灼烧;
②将灼烧产物冷却后,加入NaOH溶液进行碱浸
③过滤,滤液经过一系列的操作步骤后得到硫化钠晶体.
(1)过滤需要用到的主要玻璃仪器是漏斗、烧杯、玻璃棒.
(2)若灼烧所得气体为等物质的量的CO和CO2,写出灼烧时发生的化学反应方程为3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑.
(3)上述流程中采用a浸洗更好.
a.稀NaOH溶液b.热水c.氨水d.乙醇
(4)固体产物Na2S晶体中可能含有杂质,该课题组对固体产物的杂质成分提出以下假设:
假设一:杂质成分为NaOH;
假设二:杂质成分为Na2SO4;
假设三:杂质成分为NaOH和Na2SO4.
为验证假设三成立,课题组进行如下研究,请你完成下表中的内容:
| 实验步骤 | 预期的实验现象和结论 |
| 步骤:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的 CuCl2溶液并过滤. | \ |
| 步骤2: 取1的滤液加入酚酞试液,若溶液变红, | 说明有NaOH |
| 步骤3: 取1的滤液加入BaCl2溶液,若产生白色沉淀, | 说明有Na2SO4 |
4.用镍黑合金提取高纯氢的方法属于( )
| A. | 重结晶纯化法 | B. | 萃取纯化法 | C. | 吸附纯化法 | D. | 蒸馏纯化法 |
8.下列各装置能够达到相应实验目的是( )
| A. | 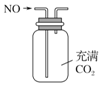 用图所示装置(正放)可收集NO气体 | |
| B. | 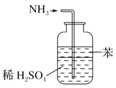 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 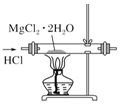 用装置制取无水MgCl2 | |
| D. | 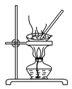 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
18.下列关于浓硫酸和稀硫酸的叙述中错误的是( )
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
5.下列化学用语正确的是( )
| A. | 氮分子的结构式  | B. | 硫原子的结构示意图 | ||
| C. | 氯化钠的电子式 | D. | 水分子的结构式 H-O-H |
2.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
2.部分中学化学常见元素原子结构及性质如表所示:
(1)A元素基态原子的外围电子排布式为3d64s2.第一电离能的大小关系:C>E(用>或<表示).
(2)B与C形成的化合物的化学式为Mg3N2,它属于离子(填“离子”或“共价”)化合物.
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,A的一种氯化物能加速Y的分解,写出该过程的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显碱性,N的结构式为 .
.
(4)B~F各元素原子半径由小到大的顺序是Mg>Si>N>O>H (用元素符号表示).
(5A的两种氯化物相互转化的离子方程式:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2.
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
(2)B与C形成的化合物的化学式为Mg3N2,它属于离子(填“离子”或“共价”)化合物.
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,A的一种氯化物能加速Y的分解,写出该过程的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显碱性,N的结构式为
 .
.(4)B~F各元素原子半径由小到大的顺序是Mg>Si>N>O>H (用元素符号表示).
(5A的两种氯化物相互转化的离子方程式:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2.