题目内容
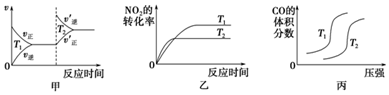
20.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
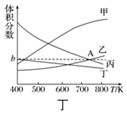
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
分析 (1)根据影响化学平衡移动的因素以及化学平衡移动的方向来判断即可,根据影响化学反应速率的因素:温度、浓度、压强、催化剂来确定化学反应达平衡用到的时间,根据影响化学平衡移动的因素:温度、浓度、压强来确定化学平衡中各个量的变化情况,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(2)①根据化学平衡三段式列式计算化学反应中物质的转化率;根据影响化学平衡移动的因素以及化学平衡移动的方向来判断即可;
②该反应为放热反应,若增大一氧化碳转化率,必须使平衡向着正向移动,所以应该降低温度;由于平衡向着正向移动,所以生成物浓度增大,反应物浓度减小,化学平衡常数增大;
(3)反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高;平衡时CH3CH2OH(g)、H2O(g)的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;
由①方向可知,图中曲线乙和丙的交点A表示平衡时CO2、H2O的含量相等,令H2与CO2的起始物质的量分别为3mol、1mol,设平衡时乙醇的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,再根据CO2、H2O的含量相对列方程计算解答;
解答 解:(1)甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误;
乙:升高温度,化学反应速率会迅速增大,所以T2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确;
丙:对于反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g),T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误;
4CO(g)+2NO2(g)?4CO2(g)+N2(g),反应的平衡常数K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$,
故答案为:乙;K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$;
(2)①根据投料情况知道,乙相当于在甲的基础上增加了水蒸气的投料,所以会使得一氧化碳的转化率增大,丙装置投料是甲装置的2倍,对于化学反应前后系数和不变的反应来说,建立的平衡是等效的,所以两种情况下,转化率是相等的,平衡时,甲、乙、丙三个容器中,CO的转化率大小关系为甲=丙<乙,
故答案为:甲=丙<乙;
②丙容器中,通过改变温度,使CO的平衡转化率增大,需要使化学平衡向着正向移动,由于该反应为放热反应,要增大一氧化碳的转化率,应该降低温度;由于平衡向着正向移动,反应物浓度减小,生成物浓度增大,则该反应的化学平衡常数增大,
故答案为:增大;
(3)反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高,
平衡时CH3CH2OH(g)、H2O(g)的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;
曲线甲、曲线乙随温度升高含量增大,且曲线Ⅰ的含量高,所以曲线甲表示H2、曲线乙表示CO2,
曲线丙、曲线丁随温度升高含量减小,且曲线丙的含量高,所以曲线丙表示H2O、曲线丁表示CH3CH2OH,
2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g);
由①方向可知,图中曲线Ⅱ和Ⅲ的交点a表示平衡时CO2、H2O的含量相等,令H2与CO2的起始物质的量分别为3mol、1mol,设平衡时乙醇的物质的量为xmol,则:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
开始(mol):1 3 0 0
变化(mol):2x 6x x 3x
平衡(mol):1-2x 3-6x x 3x
故1-2x=3x,解得x=0.2
故图中曲线乙和丙的交点A对应的体积分数b=$\frac{3x}{1-2x+3-6x+x+3x}$×100%=$\frac{3x}{4-4x}$×100%=$\frac{3×0.2}{4-4×0.2}$×100%=18.8%,
故答案为:CO2;18.8.
点评 本题目综合考查化学反应速率和化学平衡移动的影响因素以及有关化学平衡的转化率、平衡常数的计算等方面的知识,题目难度中等,注意明确影响化学反应速率、化学平衡的因素,掌握化学平衡常数的概念及计算方法.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA | |
| B. | 1 mol-OH中电子数为10 NA | |
| C. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| D. | 常温常压下,28 g丙烯和丁烯的混合气体中含有的碳原子数为2 NA |
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1,
②下列说法不正确的是CE.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率
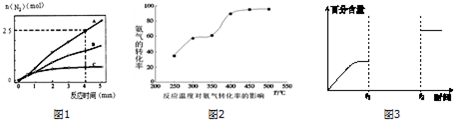
你认为反应控制的最佳温度应为C,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
| A. | NaCl是电解质,故NaCl晶体能导电 | |
| B. | 浓溶液的导电能力一定强 | |
| C. | NH4NO3电离时产生了NH4+、NO3-,无金属离子,所以NH4NO3不是盐 | |
| D. | 熔融状态下 NaHSO4的电离方程式为:NaHSO4=Na++HSO4- |
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
? +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol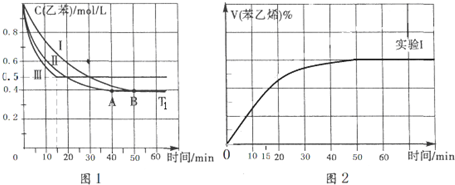

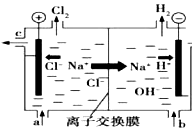 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.