题目内容
12.下列实验操作错误的是( )| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
分析 A.蒸发时应防止温度过高而导致固体迸溅;
B.蒸馏时,温度计用于测量馏分的温度;
C.分液时,应避免液体重新混合而污染;
D.萃取时,萃取剂与水互不相溶.
解答 解:A.蒸发操作时,应使混合物中的水分大部分蒸干后,待大部分晶体析出,停止加热,靠余热蒸干剩余水分,故A错误;
B.蒸馏操作时,蒸馏是依据馏出成分的沸点分离混合物,应使温度计水银球靠近蒸馏烧瓶的支管口处,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免重新混合引入杂质,故C正确;
D.萃取时,萃取剂与水互不相溶,否则不能达到分离的目的,故D正确.
故选A.
点评 本题考查化学实验中有许多的实验注意事项,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和合理性的评价,这些都涉及到化学实验的安全和基本操作.学习的时候要切记,题目较简单.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
19.反应CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 保持容积不变,增大CO2的量,NH3的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
3.合成氨需要的原料气氢气主要来自水煤气,水煤气的主要成分:CO、H2、CO2,其中一种制取方法是用炽热的炭和水蒸气反应制得.
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
(1)该反应的K值表达式为$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)体积不变的条件下,下列措施中有利于提高CO产率的是AB(填字母).
A.升高温度 B.降低压强 C.增加C用量 D.通入H2
(3)某温度下,四种容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如表所示.请填写表中相应的空格①和②.
(4)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍.平衡时水蒸气的转化率为25%;向该容器中补充amol炭,水蒸气的转化率将不变(填“增大”、“减小”、“不变”),再补充amol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为1:a.
(5)已知:C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283.0kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8kJ/mol
那么,将2.4g炭完全转化为水蒸气,然后再燃烧,整个过程△H=-78.7kJ/mol.
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
(1)该反应的K值表达式为$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)体积不变的条件下,下列措施中有利于提高CO产率的是AB(填字母).
A.升高温度 B.降低压强 C.增加C用量 D.通入H2
(3)某温度下,四种容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如表所示.请填写表中相应的空格①和②.
| 容器编号 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
(5)已知:C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283.0kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8kJ/mol
那么,将2.4g炭完全转化为水蒸气,然后再燃烧,整个过程△H=-78.7kJ/mol.
20.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).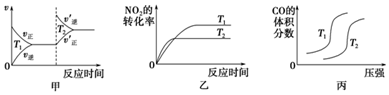
该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
①平衡时,甲、乙、丙三个容器中,CO的转化率大小关系为:甲=丙<乙(用“甲”、“乙”、“丙”,“>”、“=”或“<”表示).
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
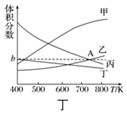
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).

17.下列实验操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处 | |
| D. | 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上 |
2.下列对于“摩尔”的理解正确的是( )
| A. | 22.4LO2中所含氧气分子计量为1摩尔 | |
| B. | 1mol氧含6.02×1023个O2 | |
| C. | 摩尔是国际科学界建议采用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |