题目内容
10.下列叙述正确的是( )| A. | NaCl是电解质,故NaCl晶体能导电 | |
| B. | 浓溶液的导电能力一定强 | |
| C. | NH4NO3电离时产生了NH4+、NO3-,无金属离子,所以NH4NO3不是盐 | |
| D. | 熔融状态下 NaHSO4的电离方程式为:NaHSO4=Na++HSO4- |
分析 A.含有自由移动离子或电子的物质能导电;
B.溶液导电性与离子浓度成正比;
C.由金属阳离子或铵根离子和酸根离子构成的纯净物是盐;
D.硫酸氢钠在熔融状态下电离出钠离子和硫酸氢根离子.
解答 解:A.含有自由移动离子或电子的物质能导电,氯化钠固体中不含自由移动离子,所以不导电,但氯化钠是由阴阳离子构成的强电解质,故A错误;
B.溶液导电性与离子浓度成正比,与溶液浓度无关,所以浓溶液导电性不一定强,故B错误;
C.由金属阳离子或铵根离子和酸根离子构成的纯净物是盐,硝酸铵是由铵根离子和酸根离子构成的纯净物,属于盐,故C错误;
D.硫酸氢钠在熔融状态下电离出钠离子和硫酸氢根离子,其电离方程式为NaHSO4=Na++HSO4-,故D正确;
故选D.
点评 本题考查基本概念、电解质与导电性关系、电解质的电离等知识点,为高频考点,侧重考查学生对基本概念的理解和判断,注意硫酸氢钠在水溶液中和熔融状态下电离方式的区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).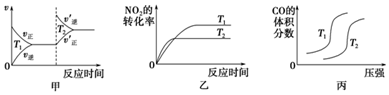
该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
①平衡时,甲、乙、丙三个容器中,CO的转化率大小关系为:甲=丙<乙(用“甲”、“乙”、“丙”,“>”、“=”或“<”表示).
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
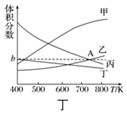
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).

5.下列物质一定互为同系物的是( )
| A. | C3H6与C5H10 | B. | 邻二甲苯与对二甲苯 | ||
| C. | C2H6与C5H12 | D. | 溴乙烷与1,2-二溴乙烷 |
2.下列对于“摩尔”的理解正确的是( )
| A. | 22.4LO2中所含氧气分子计量为1摩尔 | |
| B. | 1mol氧含6.02×1023个O2 | |
| C. | 摩尔是国际科学界建议采用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
19.下列说法正确的是( )
| A. | 变质的植物油有难闻的气味,是因为植物油发生了酯化反应 | |
| B. | 水煤气的主要成分是丁烷 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 |
20. 如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )
如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )
 如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )
如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )| A. | 当乙中混合气体总质量不再变化时即达到化学平衡 | |
| B. | 达平衡时用A表示反应速率时,v(甲)<v(乙) | |
| C. | 由于容器甲的容积在不断变化,故从反应开始到平衡所需时间比容器乙要长 | |
| D. | 达到平衡时,甲所需时间短,但两容器中A的转化率相等 |
 .
.