题目内容
7.在体积为2L的密闭容器中发生2SO2+O2?2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;
③在300℃时,10molSO2与5molO2反应;
(1)开始时,化学反应速率快慢顺序是②>①>③;
(2)若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(L•min),则V(O2)=0.2mol/(L•min),10min时,SO3浓度为4mol/L.
分析 (1)先比较温度,温度越高,反应速率越大,浓度越大,反应速率越大;
(2)反应速率之比等于化学计算数之比,结合c=v△t计算.
解答 解:(1)③的温度最低,反应速率最慢,①②比较,②中浓度大,则反应速率最大,故答案为:②>①>③;
故答案为:②>①>③;
(2)反应速率之比等于化学计算数之比,V(O2)=$\frac{1}{2}$V(SO2)=$\frac{1}{2}$×0.4mol/(L•min)=0.2mol/(L•min);V(SO3)=V(SO2)=0.4mol/(L•min),则10min时,生成的SO3浓度为0.4mol/(L•min)×10min=4mol/L;
故答案为:0.2mol/(L•min);4mol/L.
点评 本题考查影响化学反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及计算反应速率的方法为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
18.同温同压下,已知O2的密度为ρg/L,则NH3的密度为( )
| A. | $\frac{32p}{17}$ g/L | B. | $\frac{17p}{32}$ g/L | C. | $\frac{32}{17p}$ g/L | D. | $\frac{17}{32p}$ g/L |
15.下列反应的离子方程式书写不正确的是( )
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 硫化钠的水解:S2-+2H2O?H2S+2OH- | |
| C. | 向Fe(NO3)3溶液中加入过量的HI溶液:Fe3++3NO3-+10I-+12H+=5I2+Fe2++3NO↑+6H2O | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
19.反应CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 保持容积不变,增大CO2的量,NH3的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
20.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).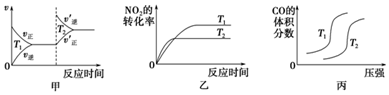
该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
①平衡时,甲、乙、丙三个容器中,CO的转化率大小关系为:甲=丙<乙(用“甲”、“乙”、“丙”,“>”、“=”或“<”表示).
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
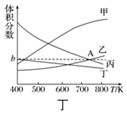
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).






 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题: