��Ŀ����
15����������Ҫ��Ⱦ����SO2��NOx��������Ԥ�����������ʵ���Һ���գ��ɼ���������SO2����NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ����NO��g��+O3��g���TNO2��g��+O2��g����H=-200.9kJ•mol-1
��NO��g��+$\frac{1}{2}$O2��g���TNO2��g����H=-58.2kJ•mol-1
��SO2��g��+O3��g��?SO3��g��+O2��g����H=-241.6kJ•mol-1
��1����Ӧ��3NO��g��+O3��g���T3NO2��g���ġ�H=-317.3 kJ•mol-1��
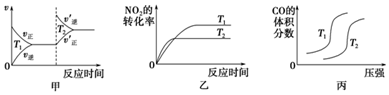
��2������������Ӧ��2NO2��g��+O3��g��?N2O5��g��+O2��g�����Է����У����¶�ΪT1Kʱ�������Ϊ2L�ĺ����ܱ������г���1mol O3��2mol NO2������������Ӧ�ݣ���25���ӷ�Ӧ��ƽ�⣬���ƽ��ʱN2O5��g����Ũ��Ϊ0.25mol•L-1��
���жϸ÷�Ӧ�ġ�S��0����H��0���������=����
�����¶�ΪT1Kʱ�÷�Ӧ��ƽ�ⳣ��K=1��
������˵����ȷ����CD��
A���ӷ�Ӧ��ʼ����ƽ�⣬NO2��ƽ����Ӧ����v��NO2��=0.04mol•L-1•min-1
B��T1Kʱ������ʼʱ�������г���1mol O3��2mol NO2��1mol O2��1mol N2O5���壬��Ӧ�ﵽƽ��ǰv��������v���棩
C�����ı䷴Ӧ�¶�ΪT2K�����ƽ��ʱNO2��Ũ��Ϊ0.60mol•L-1����T2��T1
D�� T1Kʱ��Ӧ��ƽ��ʱ���������Ϊ2L����ά��T1Kѹ������ʹNO2ת����Ϊ60%�����ʱ���������ԼΪ0.71L
����ά�������������䣬���ı��¶�ΪT2Kʱ����15���ӷ�Ӧ��ƽ�⣬���ƽ��ʱN2O5��g����Ũ��Ϊ0.20mol•L-1��������T2K�´�0��25����c��NO2����ʱ��仯ͼ1��

��3�������£������뷴Ӧ����NO��SO2�����ʵ���һ�����ı����O3�����ʵ�������Ӧһ��ʱ�����ϵ��n��NO����n��NO2����n��SO2���淴Ӧǰn��O3����n��NO���ı仯��ͼ2��
�ٵ�n��O3����n��NO����1ʱ����Ӧ��NO2�����ʵ������٣���ԭ����O3��NO2�����ɸ��۵��������������N2O5����
������n��O3����O3����SO2�ķ�Ӧ��������Ӱ�죬�����ԭ����SO2��O3�ķ�Ӧ��������
��4����ҵ�ϳ����ý���Ӧ�������Ƴ�ƽ����ϵ����߷�Ӧ���ת���ʣ��Գ�������Ӧ��SO2��g��+O3��g��?SO3��g��+O2��g�����ڲ��ı䷴Ӧ��Ͷ���¿ɲ�ȡ��ѹ�Ĵ�ʩ���SO2��ת���ʣ����ܵ���������ѹ����ʹSO3תΪ���������ƽ�������з��룬�Ӷ�ʹƽ�����������ʵ�����С�ķ����ƶ���
���� ��1����NO��g��+O3��g���TNO2��g��+O2��g����H=-200.9kJ•mol-1
��NO��g��+$\frac{1}{2}$O2��g���TNO2��g����H=-58.2kJ•mol-1
�ɸ�˹���ɣ���+2���ڿɵã�3NO��g��+O3��g���T3NO2��g������H������Ӧ�ļ��㣻
��2���ٷ�Ӧ���Է����У�˵����H-T��S��0������ӦΪ�������ʵ�����С�ķ�Ӧ�����Ҷȼ�С�����÷�Ӧ�ġ�S��0��
���ȼ���ƽ��ʱ������Ũ�ȣ��ٴ���K=$\frac{c��{N}_{2}{O}_{5}����c��{O}_{2}��}{{c}^{2}��N{O}_{2}����c��{O}_{3}��}$����ƽ�ⳣ����
��A��NO2��ƽ����Ӧ����v��NO2��=$\frac{��v��N{O}_{2}��}{��t}$��
B�������ʱ��Ũ����Qc����ƽ�ⳣ��K�Ƚ��жϷ�Ӧ���з������жϷ�Ӧ�ﵽƽ��ǰv��������v���棩��Դ�С��
C������NO2��Ũ�ȱ仯�жϸı��¶�ƽ���ƶ����������¶�ƽ�������ȷ�Ӧ�����ƶ��������¶�ƽ������ȷ�Ӧ�����ƶ���
D�����ݶ���������ת���ʼ���ƽ��ʱ��������ʵ������ٽ��ƽ�ⳣ���������������
�ܶ�����������ʼŨ�Ȳ���Ϊ1mol/L������ƽ��ʱN2O5��g����Ũ�ȿ��Լ���15minƽ��ʱ����������Ũ�ȣ��ݴ���ͼ��
��3����O3����ǿ�����ԣ���������NO2��
��O3����SO2�ķ�Ӧ��������Ӱ�죬�����Ƿ�Ӧ��������
��4����Ӧǰ����������������仯��������ѹǿƽ�������������С�ķ����ƶ���Ӧ�Ǽ�ѹ��������ת��Ϊ�����壮
��� �⣺��1����NO��g��+O3��g���TNO2��g��+O2��g����H=-200.9kJ•mol-1
��NO��g��+$\frac{1}{2}$O2��g���TNO2��g����H=-58.2kJ•mol-1
�ɸ�˹���ɣ���+2���ڿɵã�3NO��g��+O3��g���T3NO2��g�������H=��-200.9kJ•mol-1��+2��-58.2kJ•mol-1��=-317.3kJ/mol��
�ʴ�Ϊ��-317.3��
��2��������ӦΪ�������ʵ�����С�ķ�Ӧ�����Ҷȼ�С�����÷�Ӧ�ġ�S��0�����ڷ�Ӧ���Է����У�˵����H-T��S��0������֪��H��0��
�ʴ�Ϊ����������
�������Ϊ2L�ĺ����ܱ������г���1mol
O3����ʼŨ��Ϊ$\frac{1mol}{2L}$=0.5mol/L��NO2����ʼŨ��Ϊ$\frac{2mol}{2L}$=1mol/L����25���ӷ�Ӧ��ƽ�⣬���ƽ��ʱN2O5��g����Ũ��Ϊ0.25mol•L-1����
2NO2��g��+O3��g��?N2O5��g��+O2��g��
��ʼŨ�ȣ�mol/L����1 0.5 0 0
�仯Ũ�ȣ�mol/L����0.5 0.25 0.25 0.25
ƽ��Ũ�ȣ�mol/L����0.5 0.25 0.25 0.25
��ƽ�ⳣ��K=$\frac{c��{N}_{2}{O}_{5}����c��{O}_{2}��}{{c}^{2}��N{O}_{2}����c��{O}_{3}��}$=$\frac{0.25��0.25}{0��{5}^{2}��0.25}$=1��
�ʴ�Ϊ��1��
��A��NO2��ƽ����Ӧ����v��NO2��=$\frac{��v��N{O}_{2}��}{��t}$=$\frac{0.5mol/L}{25min}$=0.02mol•L-1•min-1����A����
B����ʱ��Ũ����Qc=$\frac{\frac{1}{2}��\frac{1}{2}}{��\frac{2}{2}��^{2}��\frac{1}{2}}$=0.5��k=1����Ӧ������Ӧ���н���ƽ�⣬�ʷ�Ӧ�ﵽƽ��ǰv��������v���棩����B����
C��T2Kƽ��ʱNO2��Ũ��Ϊ0.60mol•L-1������T1Kƽ��ʱNO2��Ũ�ȣ�0.50mol•L-1����˵���ı��¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ�����¶�T2��T1����C��ȷ��
D��ά��T1Kѹ������ʹNO2ת����Ϊ60%����NO2�����ʵ����仯Ϊ2mol��60%=1.2mol����
2NO2��g��+O3��g��?N2O5��g��+O2��g��
��ʼ����mol����2 1 0 0
�仯����mol����1.2 0.6 0.6 0.6
ƽ������mol����0.8 0.4 0.6 0.6
�����������ΪVL����$\frac{\frac{0.6}{V}��\frac{0.6}{V}}{��\frac{0.8}{V}��^{2}��\frac{0.4}{V}}$=1�����V=0.71����D��ȷ��
��ѡ��CD��
�ܶ�����������ʼŨ�Ȳ���Ϊ1mol/L��15minƽ��ʱ����������Ũ��Ϊ1mol/L-2��0.2mol/L=0.6mol/L����T2K�´�0��25����c��NO2����ʱ��仯ͼΪ�� ��
��
�ʴ�Ϊ�� ��
��
��3����O3����ǿ�����ԣ����Խ�NO2�����ɸ��۵��������������N2O5������Ӧ��NO2�����ʵ������٣�
�ʴ�Ϊ��O3��NO2�����ɸ��۵��������������N2O5����
��O3����SO2�ķ�Ӧ��������Ӱ�죬�����Ƿ�Ӧ��������
�ʴ�Ϊ��SO2��O3�ķ�Ӧ��������
��4����ѹ����ʹSO3תΪ���������ƽ�������з��룬�Ӷ�ʹƽ�����������ʵ�����С�ķ����ƶ������SO2��ת���ʣ�
�ʴ�Ϊ����ѹ����ʹSO3תΪ���������ƽ�������з��룬�Ӷ�ʹƽ�����������ʵ�����С�ķ����ƶ���
���� ���⿼�黯ѧƽ����㡢��������Ի�ѧƽ���ƶ�Ӱ�졢��˹���ɵ�֪ʶ�㣬���ؿ���ѧ���������жϼ������������ѵ���ͼ�����������ʽ�����Ӧ�ã���Ŀ�ѵ��еȣ�

 ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д� ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�| ������ ��� ѡ�� | ������ | ����� | ����� | �ǵ���� |
| A | �մ� | �������� | CaCO3 | �ɱ� |
| B | ��� | Ư�� | NH3•H20 | Fe |
| C | ���� | ���Ͻ� | ʯī | ���� |
| D | ���� | CuSO4•5H2O | Na2SO4 | �ƾ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
C��s��+H2O��g��?CO��g��+H2��g����H=+131.3kJ/mol
��1���÷�Ӧ��Kֵ����ʽΪ$\frac{c��CO��•c��{H}_{2}��}{c��{H}_{2}O��}$��
��2���������������£����д�ʩ�����������CO���ʵ���AB������ĸ����
A�������¶� B������ѹǿ C������C���� D��ͨ��H2
��3��ij�¶��£����������о�������������Ӧ����������̿�������������ʵ����ʵ���Ũ�ȼ����淴Ӧ���ʹ�ϵ�����ʾ������д������Ӧ�Ŀո�ٺ͢ڣ�
| ������� | c��H2O��/mol/L | c��CO��/mol/L | c��H2��/mol/L | V����V���Ƚ� |
| �� | 0.06 | 0.60 | 0.10 | V��=V�� |
| �� | 0.06 | 0.50 | 0.40 | �� |
| �� | 0.12 | 0.40 | 0.80 | V����V�� |
| �� | 0.12 | 0.30 | �� | V��=V�� |
��5����֪��C��s��+$\frac{1}{2}$O2��g��=CO��g������H=-110.5kJ/mol
CO��g��+$\frac{1}{2}$O2��g��=CO2��g������H=-283.0kJ/mol
H2��g��+$\frac{1}{2}$O2��g��=H2O��g������H=-241.8kJ/mol
��ô����2.4g̿��ȫת��Ϊˮ������Ȼ����ȼ�գ��������̡�H=-78.7kJ/mol��
 ��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��֪��K300��C��K350��C����÷�Ӧ�Ƿ��ȷ�Ӧ��
��2��ͼ�б�ʾNO2�ı仯��������b����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v=1.5��10-3mol•L-1•s-1��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����bc��
a��v ��NO2��=2v ��O2�� b��������ѹǿ���ֲ���
c��v����NO��=2v�� ��O2�� d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����c��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����
HNO2��һ�����ᣬ��������ĵ���ƽ�ⳣ�����±���
| ���� | HNO2 | HClO | H2CO3 | H2SO3 |
| ����ƽ�ⳣ�� ��25�棩 | Ki=5.1��10-4 | Ki=2.98��10-8 | $\begin{array}{l}{K_{i1}}=4.3��{10^{-7}}\\{K_{i2}}=5.6��{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54��{10^{-2}}\\{K_{i2}}=1.02��{10^{-7}}\end{array}$ |
��6���������ӷ���ʽ��ȷ����BD
A��2ClO-+H2O+CO2��2HClO+CO32-
B��2HNO2+CO32-��2NO2-+H2O+CO2��
C��H2SO3+CO32-��CO2+H2O+SO32-
D��Cl2+H2O+2CO32-��2HCO3-+Cl-+ClO-
��7�������£�pH=3��HNO2��Һ��pH=11��NaOH��Һ�������Ϻ���Һ������Ũ���ɴ�С��˳��Ϊc��NO2-����c��Na+����c��H+����c��OH-����
��1�����ڸ÷�Ӧ��4CO��g��+2NO2��g��?4CO2��g��+N2��g����H=-1 200kJ•mol-1���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ�����ң�����ţ���
�÷�Ӧ��ƽ�ⳣ������ʽΪK=$\frac{{c}^{4}��C{O}_{2}��c��{N}_{2}��}{{c}^{4}��CO��{c}^{2}��N{O}_{2}��}$��
��2������β����CO��H2O��g����һ�������¿��Է�����Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0.820��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
���������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת����������ƽ�ⳣ��K�������������С�����䡱����
��3��Ϊ���������ܼ��š��͡���̼���á���Ŀǰ��ҵ����һ�ַ�������CO2������ȼ���Ҵ���һ�������·�����Ӧ��2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��g����H��0����һ�������£���20L�ܱ������а����ʵ�����Ϊ1��3����CO2��H2���¶���450K��5MPa�²��ƽ����ϵ�и����ʵ�����������¶ȵı仯������ͼ����ʾ�������ұ�ʾ����CO2�������ʵĻ�ѧʽ�������������ͼ����A���Ӧ���������b=18.8%�����������λ��Ч���֣���
| A�� | C3H6��C5H10 | B�� | �ڶ��ױ���Զ��ױ� | ||
| C�� | C2H6��C5H12 | D�� | ��������1��2-�������� |
