题目内容
10.下列物质中:①NaCl ②NaOH ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3•H2O ⑦Fe ⑧金刚石 ⑨Cl2 ⑩澄清石灰水其中属于强电解质的有①②⑤;
属于非电解质的有:④;
能导电的有:⑦⑩(填序号)
分析 在水溶液中或熔融状态下能完全电离的化合物为强电解质;
在水溶液中或熔融状态下只能部分电离的化合物为弱电解质;
当物质中有自由移动的离子或自由移动的电子时,则物质能导电,据此分析.
解答 解:①NaCl无自由移动的电子或离子,不能导电;在水溶液中能完全电离,故为强电解质;
②NaOH无自由移动的电子或离子,不能导电;在水溶液中能完全电离,故为强电解质;
③CH3COOH无自由移动的电子或离子,不能导电;在水溶液中只能部分电离,故为弱电解质;
④CO2无自由移动的电子或离子,不能导电;在水溶液中和熔融状态下均不能导电,故为非电解质,既不是强电解质也不是弱电解质;
⑤NaHCO3无自由移动的电子或离子,不能导电;在水溶液中能完全电离,故为强电解质;
⑥NH3•H2O无自由移动的电子或离子,不能导电;在水溶液中只能部分电离,故为弱电解质;
⑦Fe能导电,但由于是单质,故既不是强电解质也不是弱电解质;
⑧金刚石不能导电,由于是单质,故既不是强电解质也不是弱电解质;
⑨Cl2不能导电,由于是单质,故既不是强电解质也不是弱电解质;
⑩澄清石灰水是溶液,有自由移动的离子,故能导电;但由于是混合物,故既不是强电解质也不是弱电解质.
故是强电解质的是①②⑤,是非电解质的是④,能导电的是⑦⑩.
故答案为:①②⑤;④;⑦⑩.
点评 本题考查了电解质非电解质、强弱电解质和物质导电的判断,应注意的是能导电的不一定是电解质,电解质不一定能导电.

练习册系列答案
相关题目
20.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
18.碳氢化合物是一种大气污染物,下列现象的产生与碳氢化合物有关的是( )
| A. | 臭氧空洞 | B. | 光化学烟雾 | C. | 酸雨 | D. | 火山爆发 |
15.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 8.4g NaHCO3固体中含有的阴阳离子总数为0.2 NA | |
| B. | 标准状况下,22.4L苯中含有的分子数为NA | |
| C. | 通常状况下,NA 个甲烷分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为1mol/L的Na2CO3溶液中,含有CO32-个数为NA |
2.已知下列热化学方程式:
(l) C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=△H1
(2)2H2(g)+O2(g)=2H2O(g)△H=△H2
由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3.则△H3等于( )
(l) C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=△H1
(2)2H2(g)+O2(g)=2H2O(g)△H=△H2
由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3.则△H3等于( )
| A. | △H1-△H2 | B. | △H1-$\frac{1}{2}$△H2 | C. | 2△H1-△H2 | D. | $\frac{1}{2}$△H2-△H1 |
19.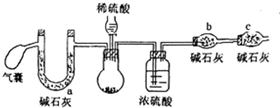 过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:
过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:
方案一:取m1g样品,加入 足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g;
方案二:取m1g样品,用如下装置测得生成二氧化碳质量为m3g;
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用cmol/L的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为VmL.
回答下列问题:
(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大;
(2)方案二中气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收,C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”或“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%.(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
…
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,1mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加酚酞试液,观察到溶液变红后褪色的时间如下:
本实验得出的结论是酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快,
设计实验验证假设二取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
 过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:
过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:方案一:取m1g样品,加入 足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g;
方案二:取m1g样品,用如下装置测得生成二氧化碳质量为m3g;
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用cmol/L的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为VmL.
回答下列问题:
(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大;
(2)方案二中气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收,C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”或“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%.(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
…
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,1mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加酚酞试液,观察到溶液变红后褪色的时间如下:
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
设计实验验证假设二取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
4.“高钙奶”中“钙”是指( )
| A. | 元素 | B. | 原子 | C. | 分子 | D. | 单质 |
 已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图:
已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图: 、
、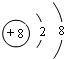 .
.