题目内容
16.Zn一MnO2干电池应用广泛,其电解质溶液是ZnCl2一NH4Cl混合溶液.(1)该电池的负极材料是Zn.电池工作时,电子流向正极(填“正极”或“负极”).
(2)若ZnCl2一NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是:Zn+Cu2+=Zn2++Cu,形成原电池发生反应.
欲除去Cu2+,最好选用下列试剂中的b(填代号).
a.NaOH b.Zn c.Fe d.NH3•H2O
(3)用此电池以石墨为电极,电解酸化的Na2SO4溶液阴极的电极反应式是:2H++2e-═H2↑.若电解电路中通过2mol电子,Zn的理论消耗量为65 g.
分析 (1)活泼金属做原电池的负极,原电池中电子从负极经外电路流向电源的正极;
(2)锌比铜活泼,能置换出铜形成原电池加速锌的腐蚀,除杂时注意不能引入新的杂质;
(3)电解酸化的Na2SO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,结合Zn~2e-计算电路中通过2mol电子时消耗Zn.
解答 解:(1)Zn-MnO2干电池中,活泼金属锌做原电池的负极,工作时原电池中电子从负极经外电路流向电源的正极,故答案为:Zn,正极;
(2)锌比铜活泼,能置换出铜,反应为Zn+Cu2+=Zn2++Cu,形成原电池加速锌的腐蚀,除杂时注意不能引入新的杂质只有b符合,
故答案为:Zn+Cu2+=Zn2++Cu,形成原电池发生反应;b;
(3)电解酸化的Na2SO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,由Zn~2e-可知若电解电路中通过2mol电子,Zn的理论消耗量为1mol×65g/mol=65g,
故答案为:2H++2e-═H2↑;65.
点评 本题考查原电池原理及应用,为高频考点,把握电极、电极反应及转移电子计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
6.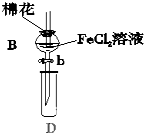 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气.
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子.
Ⅲ.接着再向B中通入一定量的SO2气体.
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子.
(1)棉花中浸润的溶液为NaOH溶液,目的是防止污染环境.
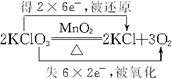
(2)实验室制备氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-.
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是SO2>Fe2+>Cl-
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是乙、丙.
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气.
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子.
Ⅲ.接着再向B中通入一定量的SO2气体.
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子.
(1)棉花中浸润的溶液为NaOH溶液,目的是防止污染环境.
(2)实验室制备氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-.
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是SO2>Fe2+>Cl-
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是乙、丙.
| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
7.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤(NH4)2CO3.
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤(NH4)2CO3.
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
11.空气是人类生存所必需的重要资源.2015年2月28日,知名媒体人柴静向多家视频网站免费奉献了大型空气污染深度公益调查-《柴静雾霾调查:穹顶之下》,唤起了新一轮关注环保的热情.下列措施不利于环保的是( )
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加大石油、煤炭的开采速度,增加化石燃料的供应量 |
8.25℃时,在浓度为1mol•L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol•L-1).下列判断正确的是( )
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |

 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+2H2O.
+CH3COONa+2H2O. ,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)
,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)
 已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图:
已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图: 、
、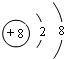 .
. .
.
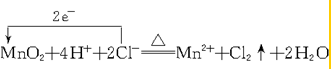 .
.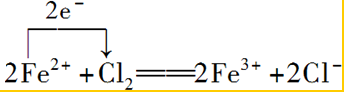 .
.