题目内容
11.如图中,A为芳香化合物,苯环上有两个邻位取代基: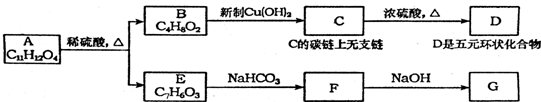
请回答:
(1)B所含的官能团的名称是羟基、醛基.
(2)反应C→D的化学方程式是
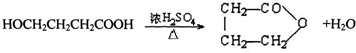 ,反应类型是酯化反应或取代反应.
,反应类型是酯化反应或取代反应.(3)A的结构简式是
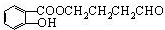 ,E的结构简式是
,E的结构简式是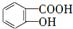 .
.(4)B有多种同分异构体,属于酯类的有4种,写出酯类中能发生银镜反应的同分异构体的结构简式HCOOCH2CH2CH3、HCOOCH(CH3)2.
分析 A为芳香族化合物,苯环上有两个邻位取代基,A在酸性条件下水解生成B和E,则A含有酯基,E能和碳酸氢钠反应生成F,说明E中含有羧基,而F能与NaOH反应,说明A、E、F中均含有酚羟基,由E的分子式可知E为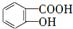 ,F为
,F为 ,G为
,G为 .E中含有羧基,则B中含有醇羟基,B能和新制氢氧化铜反应且B分子中含有2个O原子,所以B中还含有醛基,B被新制氢氧化铜氧化生成C,C上没有支链,C在浓硫酸作用下发生酯化反应生成D,D是五元环状化合物,则D的结构简式为
.E中含有羧基,则B中含有醇羟基,B能和新制氢氧化铜反应且B分子中含有2个O原子,所以B中还含有醛基,B被新制氢氧化铜氧化生成C,C上没有支链,C在浓硫酸作用下发生酯化反应生成D,D是五元环状化合物,则D的结构简式为 ,C的结构简式为:HOCH2CH2CH2COOH,B的结构简式为HOCH2CH2CH2CHO.综上分析可知A的结构简式为
,C的结构简式为:HOCH2CH2CH2COOH,B的结构简式为HOCH2CH2CH2CHO.综上分析可知A的结构简式为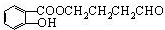 .
.
解答 解:A为芳香族化合物,苯环上有两个邻位取代基,A在酸性条件下水解生成B和E,则A含有酯基,E能和碳酸氢钠反应生成F,说明E中含有羧基,而F能与NaOH反应,说明A、E、F中均含有酚羟基,由E的分子式可知E为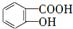 ,F为
,F为 ,G为
,G为 .E中含有羧基,则B中含有醇羟基,B能和新制氢氧化铜反应且B分子中含有2个O原子,所以B中还含有醛基,B被新制氢氧化铜氧化生成C,C上没有支链,C在浓硫酸作用下发生酯化反应生成D,D是五元环状化合物,则D的结构简式为
.E中含有羧基,则B中含有醇羟基,B能和新制氢氧化铜反应且B分子中含有2个O原子,所以B中还含有醛基,B被新制氢氧化铜氧化生成C,C上没有支链,C在浓硫酸作用下发生酯化反应生成D,D是五元环状化合物,则D的结构简式为 ,C的结构简式为:HOCH2CH2CH2COOH,B的结构简式为HOCH2CH2CH2CHO.综上分析可知A的结构简式为
,C的结构简式为:HOCH2CH2CH2COOH,B的结构简式为HOCH2CH2CH2CHO.综上分析可知A的结构简式为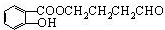 .
.
(1)B的结构简式为HOCH2CH2CH2CHO,所以B中含有醛基和羟基,故答案为:羟基、醛基;
(2)反应C→D的化学方程式是: ,该反应属于酯化反应或取代反应,
,该反应属于酯化反应或取代反应,
故答案为: ;酯化反应或取代反应;
;酯化反应或取代反应;
(3)通过以上分析知,A的结构简式为: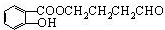 ,E的结构简式为:
,E的结构简式为: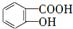 ,
,
故答案为: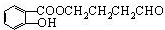 ;
;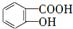 ;
;
(4)B的结构简式为HOCH2CH2CH2CHO,B有多种同分异构体,属于酯类的同分异构体有:HCOOCH2CH2CH3、HCOOCH(CH3)2、乙酸乙酯、丁酸甲酯,能发生银镜反应说明含有醛基,该有机物必须是甲酸某酯,同分异构体的结构简式为:HCOOCH2CH2CH3;HCOOCH(CH3)2,
故答案为:4;HCOOCH2CH2CH3、HCOOCH(CH3)2.
点评 本题考查有机物的推断,根据有机物的分子式、反应条件及网站结构特点进行推断,熟练掌握官能团的性质与转化,注意酚羟基不能与碳酸氢钠反应.

| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
(1)实验目的:探究同周期主族元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液.仪器:①烧杯,②试管,③胶头滴管,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
(5)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强;
[探究实验二]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应
的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化
效果的影响,设计如下对比实验:
| 实验 序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g•g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 |
(6)表中ω=74.45;
(7)从实验1、2可以得出的结论是:氯化镁固体含水量越高,催化剂催化效果越差是:..
| A. | 元素周期表中第16个纵行表示为ⅥA | |
| B. | ⅦA元素也称为卤族元素 | |
| C. | 元素周期表中,Ⅷ包括第8,9,10纵行 | |
| D. | 0族元素的原子最外层电子数为8,元素化合价为0 |
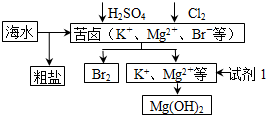
| A. | 工业上,电解熔融MgO冶炼金属镁可减小能耗 | |
| B. | 从苦卤中提取Br2的反应的离子方程式为2Br -+Cl2═2Cl-+Br2 | |
| C. | 试剂1可以选用石灰乳 | |
| D. | 可用BaCl2溶液除去粗盐中的SO42- |
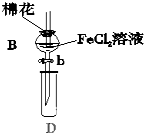 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气.
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子.
Ⅲ.接着再向B中通入一定量的SO2气体.
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子.
(1)棉花中浸润的溶液为NaOH溶液,目的是防止污染环境.
(2)实验室制备氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-.
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是SO2>Fe2+>Cl-
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是乙、丙.
| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
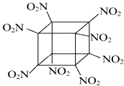 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是( )| A. | 该物质爆炸产物是N2、CO2、H2O | |
| B. | 1 mol该分子中含8 mol二氧化氮 | |
| C. | 该物质可由立方烷发生取代反应制得 | |
| D. | C、N间形成非极性键 |
| A. | 42% | B. | 48% | C. | 81% | D. | 无法确定 |
| A. |  | B. |  | C. |  | D. |  |