题目内容
3.下表是元素周期表短周期的一部分
(1)①-⑦元素中金属性最强的元素位于周期表第二周期ⅦA族.
(2)③与⑤形成的化合物化学式为Mg3N2,④所形成的单质与水发生的反应为2F2+2H2O=4HF+O2.
(3)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)HNO3>H2CO3>H2SiO3;④所在族的各元素与氢气化合所形成的气态氢化物其稳定性由强到弱顺序是(用化学式表示)HF>HCl>HBr>HI
(4)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si、⑧为S.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
(2)③与⑤形成的化合物为Mg3N2,④所形成的单质为氟气,与水反应是生成HF与氧气;
(3)非金属性越强,最高价含氧酸的酸性越强;同主族自上而下非金属性减弱,氢化物稳定性减弱;
(4)表中元素③、⑥它们最高价氧化物的水化物分别为HNO3、Al(OH)3,二者发生中和反应.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si、⑧为S.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故F元素非金属性最强,处于周期表中第二周期ⅦA族,故答案为:二、ⅦA;
(2)③与⑤形成的化合物为Mg3N2,④所形成的单质为氟气,与水反应是生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,
故答案为:Mg3N2;2F2+2H2O=4HF+O2;
(3)非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3;同主族自上而下非金属性减弱,氢化物稳定性减弱,故氢化物稳定性HF>HCl>HBr>HI,
故答案为:HNO3>H2CO3>H2SiO3;HF>HCl>HBr>HI;
(4)表中元素③、⑥它们最高价氧化物的水化物分别为HNO3、Al(OH)3,二者发生中和反应,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,熟练掌握短周期元素,有利于基础知识的巩固.

练习册系列答案
相关题目
17.NH3是一种重要的化工产品,是氮肥工业和制造硝酸、铵盐的重要原料: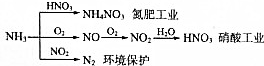
下列有关叙述错误的是( )
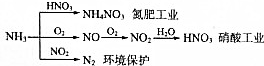
下列有关叙述错误的是( )
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
11.浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气.
试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C…)F→G→H→A→B→D→C(A、B顺序可颠倒).
(2)E中发生反应的化学方程式是CaO+NH3•H2O=Ca(OH)2+NH3↑.
(3)装置④中应当选用的干燥剂是(写名称)碱石灰.
(4)装置①中发生氧化还原反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑3H2O+3Cu.其中氧化剂是CuO,氧化产物是N2(写化学式).
(5)装置②中浓硫酸的作用是除去水蒸气和氨气.
| 序号 | ① | ② | ③ | ④ |
| 仪器装置 | 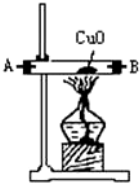 | 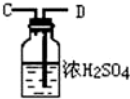 | 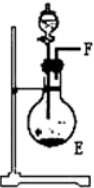 |  |
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C…)F→G→H→A→B→D→C(A、B顺序可颠倒).
(2)E中发生反应的化学方程式是CaO+NH3•H2O=Ca(OH)2+NH3↑.
(3)装置④中应当选用的干燥剂是(写名称)碱石灰.
(4)装置①中发生氧化还原反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑3H2O+3Cu.其中氧化剂是CuO,氧化产物是N2(写化学式).
(5)装置②中浓硫酸的作用是除去水蒸气和氨气.
18.在下列能级符号表示错误的是( )
| A. | 7s | B. | 2d | C. | 5f | D. | 6p |
12.下列根据实验事实得出的结论错误的是( )
| 实验事实 | 结论 | |
| A | 加碱加热产生使湿润红色石蕊试纸变蓝的气体 | 溶液中含有NH4+ |
| B | 加BaCl2溶液有白色沉淀,加稀硝酸沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 加KSCN溶液无现象•再滴加氯水变血红 | 溶液中有Fe2+ |
| D | 加热时.铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
13.下列共价化合物中,分子中每个原子最外电子层都满足8电子结构的是( )
| A. | BF3 | B. | BeCl2 | C. | PC13 | D. | SO3 |
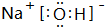 ,CB2的电子式为
,CB2的电子式为 .
.