题目内容
15.胃酸过多是常见的胃病.下面是某种治疗胃酸过多胃药的说明摘要:①白色结晶状粉末,能溶于水;②灼烧时火焰为黄色③遇酸及酸性药物产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险.(1)推测该胃药含有的主要化学成份NaHCO3(填化学式);再写出该物质一种其它用途焙制糕点用的发酵粉
(2)试写出其中含有的主要化学成份引起胃胀气反应的离子方程式:HCO3-+H+═CO2↑+H2O.
(3)三硅酸镁Mg2Si3O8•nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久.把三硅酸镁改写成氧化物形式:2MgO•3SiO2•nH2O.
分析 由信息可知,该物质能分解,水解显碱性,与酸反应生成二氧化碳,则甲中物质为碳酸氢钠,
(1)推测该胃药含有的主要化学成份是NaHCO3,焙制糕点用的发酵粉;
(2)碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳;
(3)根据镁元素、硅元素、和氢元素的化合价以及氧化物的定义进行书写.
解答 解:(1)由信息可知,该物质能分解,水解显碱性,与酸反应生成二氧化碳,则甲中主要物质为碳酸氢钠,其化学式为NaHCO3,焙制糕点用的发酵粉,故答案为:NaHCO3;焙制糕点用的发酵粉;
(2)碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,该反应的离子方程式为HCO3-+H+═CO2↑+H2O,
故答案为:HCO3-+H+═CO2↑+H2O;(2)HCO3-+H+=H2O+CO2↑
(3)镁元素显+2价,硅元素显+4价,氢元素显+1价,氧元素显-2价,氧化物中只有氧和另一种元素,故答案为:2MgO•3SiO2•nH2O.
点评 在解此类题时,首先读懂题意,然后结合学过的知识和题中的知识进行解答,需要注意物质的量的求解.

练习册系列答案
相关题目
6.下列转化关系不能通过一步反应直接完成的是( )
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
10.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图象.下列化合物分子中一定既含σ键又含π键的是( )
| A. | CO2 | B. | COCl2 | C. | C2H6O | D. | H2O2 |
7.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. |  | B. |  | C. | CH3-CH=CH-CHO | D. |  |
4.下列操作过程中不能出现“先产生沉淀然后又完全溶解”现象的是( )
①CaCl2液中通入CO2至过量
②澄淸石灰水通入SO2至过量
③氢氧化铁胶体中滴加稀硫酸至过量
④FeCl3溶液中逐滴加人氢氡化钠溶液至过量.
①CaCl2液中通入CO2至过量
②澄淸石灰水通入SO2至过量
③氢氧化铁胶体中滴加稀硫酸至过量
④FeCl3溶液中逐滴加人氢氡化钠溶液至过量.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
5.在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)+Q (Q>0 ).下列有关说法错误的是( )
| A. | 平衡前,随着反应的进行,容器内压强变小 | |
| B. | 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度平衡常数增大 | |
| D. | 其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
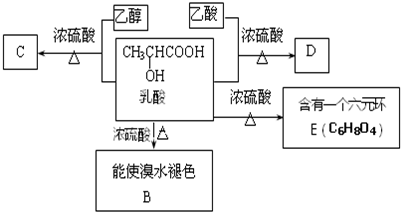
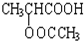 ;
;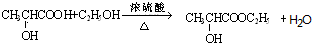 ;
;