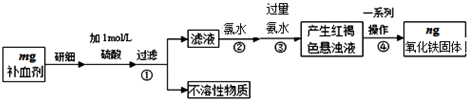
题目内容
4.意大利科学家使用普通氧分子和带正电的氧离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.(1)下列有关O4的说法正确的是:D
A.O4分子内存在极性共价键
B.O4与O3、O2都是氧的同素异形体,合成O4的反应可看作核聚变反应,
C.不属于化学变化
D.O4将来可用作更强有力的火箭推进的氧化剂
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述变化中,②(填序号)相当于氧分子被还原;①③(填序号)相当于氧分子被氧化.
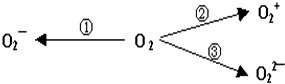
(3)写出O22-的电子式:

(4)O2+中的电子数为:15.
分析 (1)A.根据同非金属元素的原子之间不能形成极性共价键判断;
B.合成O4的反应中元素种类不变,但属于化学变化;
C.同素异形体转化属于化学变化;
D.对比O3、O2的性质,O4的氧化性更强;
(2)元素化合价升高,被氧化; 元素化合价降低,被还原;
(3)O22-的电子式为: ;
;
(4)O2+的电子数分别为:8×2-1=15.
解答 解:(1)A.同非金属元素的原子之间只能形成非极性共价键,故A错误;
B.合成O4的反应中元素种类不变,但属于化学变化,故B错误;
C.O4与O3、O2都是氧元素组成的不同单质,属于同素异形体,结构不同,所以同素异形体转化属于化学变化,故C错误;
D.对比O3、O2的性质,O4的氧化性更强,可用作更强有力的火箭推进的氧化剂,故D正确.
故答案为:D;
(2)由氧气制备含O2+的变化中,元素化合价升高,相当于氧分子被氧化; 制备含O2-、O22-的变化中,元素化合价降低,相当于氧分子被还原,
故答案为:②;①③;
(3)O22-的电子式为: ,
,
故答案安为: ;
;
(4)O2+中的电子数分别为:8×2-1=15,
故答案为:15.
点评 本题考查了同素异形体、极性键和非极性键等知识,难度不大.

练习册系列答案
相关题目
15.通入水中不能形成电解质溶液的气体是( )
| A. | HCl | B. | NH3 | C. | CH4 | D. | CO2 |
12.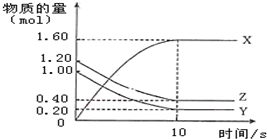 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
19.下列说法中正确的是( )
| A. | 气态单质分子中一定存在共价键 | |
| B. | 氯化钠熔化或氯化氢溶于水时都要破坏化学键 | |
| C. | 金属甲、乙各1mol均和足量的盐酸反应,甲比乙失电子多,说明甲的金属性比乙的金属性强 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
9.结合表回答下列问题:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:
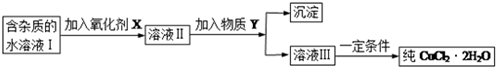
(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
13.检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( )
| A. | 稀硝酸 | B. | KSCN溶液 | C. | 溴水 | D. | 酸性KMnO4溶液 |
14.某反应过程如图所示,关于该反应的下列说法中不正确的是( )


| A. | 该反应可能为可逆反应 | |
| B. | 该反应可表示为2AB2?2AB3 | |
| C. | 单位时间内生成1 mol B2的同时生成2 mol AB2,这表明该反应已达平衡 | |
| D. | 该过程中,已反应的AB2占AB2总数的$\frac{2}{3}$ |