题目内容
19.下列说法中正确的是( )| A. | 气态单质分子中一定存在共价键 | |
| B. | 氯化钠熔化或氯化氢溶于水时都要破坏化学键 | |
| C. | 金属甲、乙各1mol均和足量的盐酸反应,甲比乙失电子多,说明甲的金属性比乙的金属性强 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
分析 A、稀有气体的单质中不存在化学键;电解质电离时破坏化学键;
B、电解质电离时破坏化学键;
C、金属性强弱是失电子的难易程度,与失电子的多少无关;
D、原电池不能从自然界直接获得.
解答 解:A、因稀有气体的单质为单原子构成的分子,则不存在化学键,即单质分子中不一定存在共价键,故A错误;
B、氯化钠熔化破坏离子键,HCl溶于水破坏共价键,故B正确;
C、金属性强弱是失电子的难易程度,与失电子的多少无关,金属性越强越易失电子,故C错误;
D、原电池不能从自然界直接获得,不是一次能源,故D错误.
故选B.
点评 本题考查了化学键和能量的转化、原电池原理,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.利用钴渣[含Co203•CoO、少量Fe2O3等金属氧化物,氧化性:Co3+>Fe3+],制备钴氧化物的工艺流程如图:

(1)Co203“溶解还原”的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)将浸液在空气中搅拌,生成红褐色絮状物,用离子方程式表示过程变化4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.然后加入NH4HCO3调节pH=3.7~8时有大量红褐色沉淀生成,解释其原因加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成.
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液可以制得Co2O3.阳极发生的电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,观察到阴极石墨电极上包裹铜层;若电解液中不加入CuSO4时,出现的主要问题是阴极上Co3+获得电子生成Co2+,Co2+的利用率降低.
(4)在空气中煅烧CoC2O4•2H2O(M为183g/mol),在不同温度下分别得到一种固体物质,充分煅烧5.49g该晶体,测得其残留质量如表:
经测定,210℃~320℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为3CoC2O4+2O2$\frac{\underline{\;210℃~320℃\;}}{\;}$Co3O4+6CO2.

(1)Co203“溶解还原”的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)将浸液在空气中搅拌,生成红褐色絮状物,用离子方程式表示过程变化4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.然后加入NH4HCO3调节pH=3.7~8时有大量红褐色沉淀生成,解释其原因加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成.
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液可以制得Co2O3.阳极发生的电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,观察到阴极石墨电极上包裹铜层;若电解液中不加入CuSO4时,出现的主要问题是阴极上Co3+获得电子生成Co2+,Co2+的利用率降低.
(4)在空气中煅烧CoC2O4•2H2O(M为183g/mol),在不同温度下分别得到一种固体物质,充分煅烧5.49g该晶体,测得其残留质量如表:
| 温度范围(℃) | 残留固体质量(g) |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
7.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子的电子式是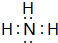 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键.
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
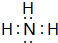 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. (2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键.
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
14.归纳整理是科学学习的重要方法之一.氧族元素的部分性质归纳整理如下:
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:113℃~450℃
(2)碲(Te)可能的化合价有:-2,+4,+6
(3)硒(Se)的原子半径可能在0.102~0.136之间.
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐减弱(增强、减弱).
元素 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218,4 | 113 | ? | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 989 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
| 原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
| 单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
(1)硒的熔点范围可能是:113℃~450℃
(2)碲(Te)可能的化合价有:-2,+4,+6
(3)硒(Se)的原子半径可能在0.102~0.136之间.
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐减弱(增强、减弱).
11.用已知浓度的NaOH滴定未知浓度的盐酸,下列操作(其他操作正确) 会造成测定结果偏高的是( )
| A. | 滴定终点读数时俯视读数 | |
| B. | 锥形瓶洗净后未干燥 | |
| C. | 碱式滴定管滴定前尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 酸式滴定管使用前,水洗后未用待测盐酸润洗 |
8.电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )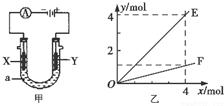

| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
9.下列基态原子或离子的电子排布式书写不正确的是( )
| A. | Fe3+离子:1s22s22p63s23p63d5 | |
| B. | Cu原子:1s22s22p63s23p63d94s2 | |
| C. | Ni2+离子:1s22s22p63s23p63d8 | |
| D. | Ga原子:1s22s22p63s23p63d104s24p1 |
 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.