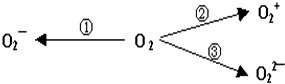题目内容
14.某强碱性溶液中含有的离子是K+、NH4+、Al3+、AlO2-、CO32-、SiO32-、OH-、Cl-中的某几种,进行如下实验:①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;②另取少量溶液,加入盐酸其发生的现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
试回答下列问题:
(1)原溶液中肯定存在的离子是OH-,K+,CO32-,肯定不存在的离子是Al3+,SiO32-,NH4+.
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,再加入足量的硝酸银溶液可得到沉淀0.287g,则原溶液中有Cl-(填有或无),若有Cl-的物质的量为0.001mol
(3)请写出此题 ②中发生的所有反应的离子方程式:H++OH-═H2O,H++AlO2-+H2O═Al(OH)3↓,2H++CO32-═CO2↑+H2O,3H++Al(OH)3═Al3++3H2O.
分析 (1)强碱性溶液中OH-能分别与NH4+、Al3+、反应,则溶液中不存在NH4+、Al3+;
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成,则溶液中不含SiO32-;
②开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失,则存在AlO2-、CO32-;
(2)n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.001mol,则含有氯离子;再结合溶液不显电性来分析解答;
(3)根据实验现象确定存在的离子并书写离子方程式.
解答 解:(1)强碱性溶液中OH-能分别与NH4+、A13+、反应,则溶液中不存在NH4+、A13+;
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成,因硅酸为沉淀,则溶液中不含SiO32-;
②开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失,则偏铝酸根离子与酸反应生成沉淀,然后碳酸根离子与酸反应生成气体,再沉淀与酸反应而溶解,所以原溶液中存在AlO2-、CO32-;又溶液不显电性,则一定存在阳离子,即存在K+,
原溶液中肯定存在的是:AlO2-、CO32、K+、OH-,肯定不存在的是NH4+、A13+、SiO32-.
故答案为:OH-,K+,CO32-,AlO2-;Al3+,SiO32-,NH4+;
(2)n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.001mol,则含有氯离子,故答案为:有;0.001mol;
(3)试验中生成沉淀的反应有:H++OH-═H2O,H++AlO2-+H2O═Al(OH)3↓,2H++CO32-═CO2↑+H2O,3H++Al(OH)3═Al3++3H2O,故答案为:H++OH-═H2O,H++AlO2-+H2O═Al(OH)3↓,2H++CO32-═CO2↑+H2O,3H++Al(OH)3═Al3++3H2O.
点评 本题考查了常见离子的检验,注意离子的特征离子反应以及现象、离子之间的干扰是关键,难度不大.

 走进文言文系列答案
走进文言文系列答案| 选项 | 反应类型 | 反应条件 |
| A | 加成反应、取代反应、消去反应 | NaOH醇溶液/加热、NaOH水溶液/加热、常温 |
| B | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| C | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
| D | 氧化反应、取代反应、消去反应 | 加热、NaOH醇溶液/加热、NaOH水溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 接触法制备硫酸主要的设备有沸腾炉、合成塔和吸收塔 | |
| B. | 工业制备硫酸中,尾气二氧化硫使用NaOH溶液吸收的 | |
| C. | 工业制备硫酸中,三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全 | |
| D. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出热量 |
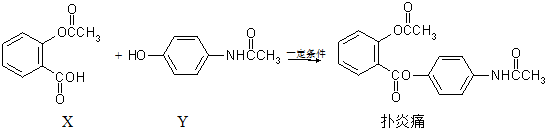
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置. 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.