题目内容
13.检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( )| A. | 稀硝酸 | B. | KSCN溶液 | C. | 溴水 | D. | 酸性KMnO4溶液 |
分析 先考虑如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色,据此分析.
解答 解:FeCl2 与硝酸、高锰酸钾、溴水均能发生氧化还原反应,被氧化为Fe3+,不能检验FeCl2溶液是否氧化变质;如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故B正确;
故选B.
点评 本题考查了铁离子、亚铁离子的检验方法,题目难度不大,注意掌握检验Fe3+的试剂:KSCN(溶液变血红色)、苯酚(溶液呈紫色).

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
3.解热镇痛抗炎药扑炎痛可由化合物X、Y在一定条件下反应合成.下列有关叙述正确的是( )
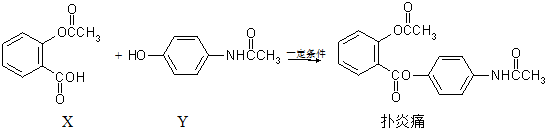

| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
1.某烷烃的相对分子质量为72,跟氯气发生取代反应所得的一氯取代物没有同分异构体,这种烷烃是( )
| A. | CH3CH2CH2CH2CH3 | B. | 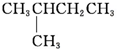 | C. |  | D. | 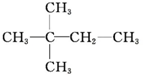 |
8.电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )

| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
18.下列物质能促进水的电离的是( )
| A. | 碳酸钠 | B. | 醋酸 | C. | 乙醇 | D. | 氯化钠 |
5. 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
 +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$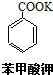 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
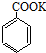 +HCl→
+HCl→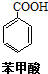 +KCl
+KCl
已知有关化合物的相关数据如表所示:
苯甲酸在100g水中的溶解度:0.18g(4℃),0.27g(18℃),2.2g(75℃).
合成:如图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾.经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物.
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤.
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥.
请回答下列有关问题:
(1)实验中准确量取4.23mL甲苯所需仪器为酸式滴定管.
(2)冷凝管的上口是否需要塞上塞子否(填“是”或“否”),a处水流方向是进水(填“进水”或“出水”).
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由避免反应过快,使反应液从回流管上端喷.
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是除去活性炭,减少苯甲酸结晶析出;“④”的操作名称是冷却结晶;可证明“⑥洗涤”步骤已洗涤干净的方法是取最后一次洗涤液,加入用HNO3酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀已洗涤干净.
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为60%.
 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下: +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O  +HCl→
+HCl→ +KCl
+KCl已知有关化合物的相关数据如表所示:
| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
合成:如图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾.经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物.
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤.
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥.
请回答下列有关问题:
(1)实验中准确量取4.23mL甲苯所需仪器为酸式滴定管.
(2)冷凝管的上口是否需要塞上塞子否(填“是”或“否”),a处水流方向是进水(填“进水”或“出水”).
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由避免反应过快,使反应液从回流管上端喷.
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是除去活性炭,减少苯甲酸结晶析出;“④”的操作名称是冷却结晶;可证明“⑥洗涤”步骤已洗涤干净的方法是取最后一次洗涤液,加入用HNO3酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀已洗涤干净.
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为60%.

 ;
; ;
;