题目内容
9.pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL.①三种溶液中物质的量浓度最大的是CH3COOH.
②分别用0.1mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是CH3COOH.
③反应开始时,反应速率D.
A.HCl最快 B.H2SO4最快 C.CH3COOH最快 D.一样快.
分析 ①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比;
③反应速率与氢离子浓度成正比.
解答 解:①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比,所以pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)溶液其浓度大小顺序是CH3COOH>HCl>H2SO4,则浓度最大的是CH3COOH;
故答案为:CH3COOH;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比,pH相等、体积相等的硫酸和盐酸中氢离子的物质的量相等,醋酸的物质的量浓度最大,则相同体积同pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以消耗氢氧化钠体积最多的是CH3COOH;
故答案为:CH3COOH;
③反应速率与氢离子浓度成正比,开始时,三种酸中氢离子浓度相等,所以其开始反应速率相等,故答案为:D.
点评 本题考查较综合,涉及弱电解质的电离、酸碱混合溶液定性判断、反应速率的判断等知识点,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
14.下列解释事实的方程式不正确的是( )
| A. | 测0.1mol•L-1氨水的pH为11:NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| B. | 将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ | |
| C. | 铝片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- |
20.下列表达方式错误的是( )
| A. | 甲烷的电子式 | B. | 碳-12原子:612C | ||
| C. | 氟化钠的电子式 | D. | 硫离子的结构示意图 |
17.下面是利用盐桥电池从某些含碘盐中提取碘的两个装置,下列说法中正确的是( )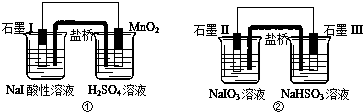

| A. | 两个装置中石墨I和石墨II作负极 | |
| B. | 碘元素在装置①中被氧化,在装置②中被还原 | |
| C. | ①中MnO2的电极反应式为:MnO2+2H2O+2e-═Mn2++4OH? | |
| D. | 反应①、②中生成等量的I2时导线上通过的电子数之比为1:5 |
1.下列离子方程式中书写正确的是( )
| A. | 碳酸氢铵溶液与足量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 氯化铝溶液显酸性:Al3++3H2O?Al(OH)3↓+3H + |
18.按照物质的树状分类和交叉分类,HNO3应属于A( )
①酸
②氧化物
③含氧酸
④一元酸
⑤电解质
⑥混合物
⑦无机化合物.
①酸
②氧化物
③含氧酸
④一元酸
⑤电解质
⑥混合物
⑦无机化合物.
| A. | ①②③④⑤⑦ | B. | ①④⑥⑦ | C. | ①②③④⑥ | D. | ①③④⑤⑦ |
 .
.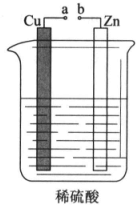 课外小组的同学对如图所示的实验装置进行了研究.
课外小组的同学对如图所示的实验装置进行了研究.