题目内容
19.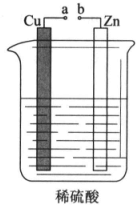 课外小组的同学对如图所示的实验装置进行了研究.
课外小组的同学对如图所示的实验装置进行了研究.(1)a和b不连接时,烧杯中发生反应的离子方程式是Zn+2H+=Zn2++H2↑,反应中的氧化剂是H+(或H2SO4).
(2)将a和b用导线连接.
①Cu电极上的现象是产生大量气泡.
②Zn电极为原电池的负极(填“正”或“负”),该电极反应式是Zn-2e-=Zn2+.
分析 (1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应;硫酸中的氢离子的化合价降低;
(2)a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,由此分析解答.
解答 解:(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,硫酸中的氢离子的化合价降低,所以氢离子是氧化剂,故答案为:Zn+2H+=Zn2++H2↑; H+(或H2SO4);
(2)a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,
①Cu电极上是氢离子放电,生成氢气,所以现象是产生大量气泡;
②Zn是活泼性强于铜,锌电极为原电池的负极,该电极反应式是Zn-2e-=Zn2+;
故答案为:①产生大量气泡;②负、Zn-2e-=Zn2+.
点评 本题考查原电池原理、氧化还原反应的有关计算等知识点,明确原电池电极反应式的书写是解题关键,比较简单.

练习册系列答案
相关题目
10.下列气体在同温同压时,密度最大的是( )
| A. | O2 | B. | SO2 | C. | Cl2 | D. | NH3 |
14.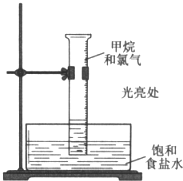 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )| 现象 | 解释 | |
| A. | 量筒内气体颜色逐渐变浅 | 甲烷被氯气还原 |
| B. | 量筒内出现少量白雾 | 生成HCl气体 |
| C. | 量筒内壁产生油状液滴 | 油状液体是CCl4 |
| D. | 量筒中液面降低 | 生成液态产物 |
| A. | A | B. | B | C. | C | D. | D |
8.下列物质中,不属于合金的是( )
| A. | 硬铝 | B. | 黄铜 | C. | 不锈钢 | D. | 水银 |
1.下列化合物不属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 油脂 | C. | 纤维素 | D. | 蛋白质 |
 如图是实验室制 Cl2 的装置图.
如图是实验室制 Cl2 的装置图.