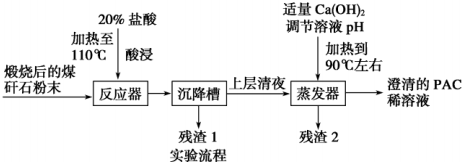
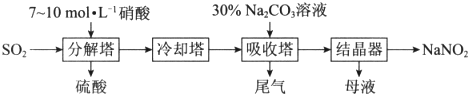
题目内容
14.A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A是原子半径最小的元素,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:(1)C的原子结构示意图为
 .
.(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)D和E两种元素相比较,其原子得电子能力较强的是氧(写名称).
以下说法中,可以证明上述结论的是bc (填写编号).
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是H++HSO32-═SO2↑+H2O.
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y.在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X>Y(选填“>”“=”或“<”).
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为12.
分析 原子半径最小的元素是氢;最外层电子数是次外层电子数的2倍,B元素是碳;题意说明C元素的氢化物溶液为碱性,故是氮元素;E元素为第3周期元素,故其最外层电子数为6,所以D、E是氧、硫,则F是氯;
(1)C是N元素,其原子核内有7个质子、核外有7个电子;
(2)D元素单质与钠反应生成的化合物可以作潜水面具中的供氧剂,为过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气;
(3)元素的非金属性越强,其形成的化合物中显负化合价,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强;
(4)A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐分别是硫酸氢钠和亚硫酸氢钠,二者反应生成二氧化硫和水;
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y,X为醋酸、Y为HCl,pH相等的这两种酸中,醋酸浓度大于盐酸,且反应过程中醋酸继续电离出氢离子,反应速率与氢离子浓度成正比;
(6)工业上用电解饱和食盐水的方法制取氯气,阴极上生成氢气、阳极上生成氯气,根据氢气与氢氧根离子之间的关系式计算氢氧根离子浓度,再根据离子积常数计算氢离子浓度,从而计算溶液的pH.
解答 解:原子半径最小的元素是氢;最外层电子数是次外层电子数的2倍,B元素是碳;题意说明C元素的氢化物溶液为碱性,故是氮元素;E元素为第3周期元素,故其最外层电子数为6,所以D、E是氧、硫,则F是氯.
(1)C是N元素,其原子核内有7个质子、核外有7个电子,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)D元素单质与钠反应生成的化合物可以作潜水面具中的供氧剂,为过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)这两种元素分别O、S元素,非金属性较强的是O元素,
a.氧、硫同主族,故氧的非金属性比硫强.沸点是物质的物理性质,不能作为判断非金属性强弱的依据,故a错误;
b.S、O形成的化合物中,共用电子对偏向非金属性强的元素,故b正确;
c.氢化物的稳定性可以作为判断非金属性强弱的依据,而其水溶液酸性强弱不能作为判断非金属性强弱的依据,故c正确;
d.非金属性强弱与其氢化物水溶液酸性强弱无关,故d错误;
故答案为:氧;b、c;
(4)A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐分别是硫酸氢钠和亚硫酸氢钠,二者反应生成二氧化硫和水,离子方程式为H++HSO32-═SO2↑+H2O,
故答案为:H++HSO32-═SO2↑+H2O;
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y,X为醋酸、Y为HCl,pH相等的这两种酸中,醋酸浓度大于盐酸,且反应过程中醋酸继续电离出氢离子,反应速率与氢离子浓度成正比,所以反应过程中醋酸中氢离子浓度大于HCl,则醋酸反应快,
故答案为:>;
(6)电解NaCl溶液:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,故产生OH-的物质的量:n(OH-)=2n(H2)=$\frac{(11.2×1{0}^{-3})L}{22.4L/mol}$×2=10-3mol,c(OH-)=$\frac{1{0}^{-3}mol}{0.1L}$=10-2mol•L-1,根据水的离子积常数,可知c(H+)=10-12mol•L-1,pH=12,
故答案为:12.
点评 本题考查位置结构性质相互关系及运用,为高频考点,明确原子结构、元素周期表结构、电解原理、弱电解质电离、元素周期律等知识点是解本题关键,综合性较强,难点是(6)的pH计算,题目难度不大.

| A. | 酸性氧化物 | B. | 电解质 | C. | 离子化合物 | D. | 有机物 |
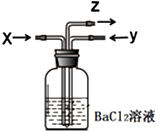 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是BaCO3 | B. | Z导管出来的气体中无CO2 | ||
| C. | 洗气瓶中产生的沉淀只有BaSO4 | D. | 洗气瓶中产生的沉淀可能有BaSO3 |
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | X、Y、Z离子半径依次增大 | |
| C. | Y和Z形成的简单离子都会破坏水的电离 | |
| D. | W、X、Z对应气态氢化物稳定性依次增强 |