题目内容
14.将0.46mol SO2和0.22mol氧气放入容积为2L的密闭容器中,发生反应2SO2 (g)+O2 (g)?2SO3 (g),在一定温度下,反应达到平衡,得到0.24mol SO3,则反应的平衡常数K=23.8.若温度不变,再加入1.0mol氧气后重新达到平衡,则SO2的平衡浓度减小(填“增大”、“不变”或“减小”),氧气的转化率降低(填“升高”、“不变”或“降低”),SO3的体积分数减小(填“增大”、“不变”或“减小”).分析 将0.46mol SO2和0.22mol氧气放入容积为2L的密闭容器中,发生反应2SO2 (g)+O2 (g)?2SO3 (g),在一定温度下,反应达到平衡,得到0.24mol SO3,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.23 0.11 0
变化浓度(mol/L):0.12 0.06 0.12
平衡浓度(mol/L):0.11 0.05 0.12
根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算K、影响化学平衡的因素分析温度不变,再加入1.0mol氧气后平衡正向移动的变化.
解答 解:将0.46mol SO2和0.22mol氧气放入容积为2L的密闭容器中,发生反应2SO2 (g)+O2 (g)?2SO3 (g),在一定温度下,反应达到平衡,得到0.24mol SO3,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.23 0.11 0
变化浓度(mol/L):0.12 0.06 0.12
平衡浓度(mol/L):0.11 0.05 0.12
则化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.1{2}^{2}}{0.1{1}^{2}×0.05}$=23.8;
若温度不变,再加入1.0mol氧气,则平衡正向移动,重新达到平衡,则 SO2的平衡浓度增大,但氧气的转化率降低,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):0.22 0.1+1.0 0.24
变化量(mol):2x x 2x
二次平衡(mol):0.22-2x 1.1-x 0.24+2x
二次平衡时SO3的体积分数:$\frac{0.24+2x}{0.22-2x+1.1-x+0.24+2x}$=$\frac{0.24+2x}{1.56-x}$,而x的极大值为0.1,故$\frac{0.24+2x}{1.56-x}$的极大值为30%,三氧化硫的体积分数减小;
故答案为:23.8; 减小; 降低;减小.
点评 本题考查化学平衡计算,(2)中二次平衡时三氧化硫体积分数判断为易错点,注意利用极限法进行解答,难度中等.

| A. | 若三种溶液中c(H+)分别为a1 mol•L-1、a2 mol•L-1、a3 mol•L-1,则它们的大小关系为$\frac{1}{2}$a2=a1=a3 | |
| B. | 等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为b1 mol、b2 mol、b3 mol,则它们的大小关系为b1=b2<b3 | |
| C. | 分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为V1=V2=V3 | |
| D. | 分别与Zn反应,开始时生成H2的速率分别为v1、v2、v3,其大小关系为v2>v1>v3 |
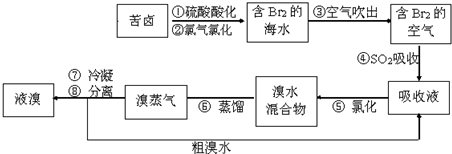
| A. | 步骤④⑤是为了富集溴 | |
| B. | 步骤③说明溴具有挥发性 | |
| C. | 步骤④的离子方程式为Br2+SO2+H2O═2H++2Br-+SO32- | |
| D. | 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
 .(以上均用元素符号表示)
.(以上均用元素符号表示)
