题目内容
5.在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入约10gNH4Cl晶体,并立即用玻璃棒搅拌,使Ba(OH)2•8H2O与NH4Cl充分反应.(1)实验中玻璃棒的作用是搅拌,使反应物充分混合,加快反应速率.
(2)实验中观察到的现象是有刺激性气味的气体生成;璃片与烧杯粘在一起.产生上述现象的原因是反应混合物成糊状,生成氨气;反应吸热玻璃片上的水结冰.
(3)通过玻璃片与烧杯粘在一起现象,说明该反应是吸热反应,这是由于反应物所具有的总能量小于(填“大于”、“小于”或“等于”)生成物所具有的总能量.
分析 Ba(OH)2•8H2O与NH4Cl在玻璃棒作用下反应生成氯化钡、氨气,为吸热反应,可观察到玻璃片与烧杯粘在一起;反应混合物成糊状,以此解答该题.
解答 解:(1)为了使反应物迅速混合而充分反应,使温度迅速下降,从而使反应现象更加明显,所以实验中要立即用玻璃棒迅速搅拌,
故答案为:故答案为:搅拌,使反应物充分混合,加快反应速率;
(2 )实验可观察到有刺激性气味的气体生成,玻璃片与烧杯粘在一起,原因是反应混合物成糊状,生成氨气,反应吸热玻璃片上的水结冰;反应中有水生成,溶解部分反应混合物,
故答案为:有刺激性气味的气体生成;玻璃片与烧杯粘在一起;反应混合物成糊状,生成氨气;
(3)通过玻璃片上结冰现象,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,反应物的总能量小于生成物的总能量,
故答案为:玻璃片与烧杯粘在一起;吸热;小于.
点评 本题考查了化学反应中的能量变化以及吸热反应、放热反应与反应条件的关系,题目难度中等,以Ba(OH)2•8H2O与NH4Cl固体的反应为背景考查了分析问题、解决问题的能力和实验设计能力;反应放出或吸收的热量可以通过触觉感知,也可以通过温度计测量.

练习册系列答案
相关题目
3.下列叙述正确的是( )
| A. | 将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL | |
| C. | 0.270 kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L |
13.一定条件下可逆反应X(g)+3Y(g)?2Z(g),X、Y、Z的起始浓度分别为a mol•L-1、b mol•L-1、c mol•L-1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol•L-1、0.6mol•L-1、0.18mol•L-1,则下列判断正确的是( )
| A. | a:b=3:1 | |
| B. | X、Y的转化率相等 | |
| C. | Y和Z的生成速率之比为2:3可做平衡标志 | |
| D. | a的取值范围为0 mol•L-1<a<0.18 mol•L-1 |
20.用图所示装置进行实验,下表中所得结论正确的是( )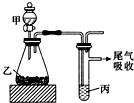

| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
10.下列离子方程式,书写正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 盐酸与碳酸钠溶液反应CO32-+2H+═CO2↑+H2O | |
| C. | 硝酸银溶液中加入铜粉Ag++Cu═Cu2++Ag | |
| D. | 铁与稀盐酸反应2Fe+6H+═2Fe3++3H2↑ |
15.下列电离方程式错误的是( )
| A. | Ba( NO3-)2=Ba2++( NO3-) 2 | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | KClO3=K++ClO3- |

