题目内容
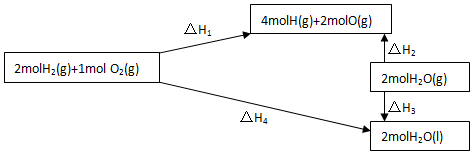
11.在3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O反应中,HNO3是氧化剂;Cu是还原剂;Cu元素被氧化;N元素被还原;被还原的HNO3与参加反应的HNO3物质的量之比是1:4.分析 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中Cu元素的化合价升高,N元素的化合价降低,8mol硝酸参加反应时只有2mol作氧化剂,以此来解答.
解答 解:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中Cu元素的化合价升高,N元素的化合价降低,HNO3是氧化剂;Cu是还原剂;Cu元素被氧化;N元素被还原;8mol硝酸参加反应时只有2mol作氧化剂,则被还原的HNO3与参加反应的HNO3物质的量之比是2mol:8mol=1:4,
故答案为:HNO3;Cu;Cu;N;1:4.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
1.常温下c(H+)最小的是下列各项中的( )
| A. | pH=0的溶液 | B. | 0.5mol•L-1H2SO4 | ||
| C. | 0.5mol•L-1HCl | D. | 0.5mol•L-1CH3COOH |
3.下列叙述正确的是( )
| A. | 将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL | |
| C. | 0.270 kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L |
13.一定条件下可逆反应X(g)+3Y(g)?2Z(g),X、Y、Z的起始浓度分别为a mol•L-1、b mol•L-1、c mol•L-1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol•L-1、0.6mol•L-1、0.18mol•L-1,则下列判断正确的是( )
| A. | a:b=3:1 | |
| B. | X、Y的转化率相等 | |
| C. | Y和Z的生成速率之比为2:3可做平衡标志 | |
| D. | a的取值范围为0 mol•L-1<a<0.18 mol•L-1 |
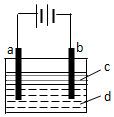 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.