题目内容
11.下列事实能说明物质的性质影响化学反应速率的是( )| A. | 常温下,二氧化锰与浓盐酸不反应,而高锰酸钾与浓盐酸反应产生氯气 | |
| B. | 接触面相近的锌粒与1mo1•L-1的盐酸反应比1mo1•L-1的硫酸反应快 | |
| C. | 同质量的煤块在空气中燃烧比煤粉燃烧要慢 | |
| D. | 甲烷与氯气的混合气体在暗室中黄绿色变浅速率比在太阳照射下慢 |
分析 反应物本身的性质为决定反应速率的决定性因素,而温度、浓度、放电等均为外因,以此来解答.
解答 解:A.二氧化锰和高锰酸钾氧化性不同,与物质的性质有关,故A选;
B.氢离子浓度不同,反应速率不同,与性质无关,故B不选;
C.固体表面积不同,反应速率不同,故C不选;
D.光照为反应的条件,强度不同,反应速率不同,故D不选.
故选A.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大,注意影响反应速率的内因和外因.

练习册系列答案
相关题目
2.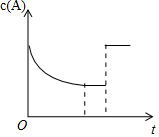 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )| A. | x=2,C为气态,D可能为气态也可能为非气态 | |
| B. | 改变的条件可能是使用了催化剂 | |
| C. | 其他条件不变,若向容器中再加入少量C,平衡逆向移动但平衡常数不变 | |
| D. | 该反应的化学平衡常数K=$\frac{{c}^{2}(C)}{[c(A)•c(B)]}$,且温度升高,K值增大 |
6.下列物质中熔点高低关系正确的是( )
| A. | NaCl>NaF | B. | BaO>CaO | C. | H2S>H2O | D. | SiO2>CO2 |
16. 如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4•10H2O)在温度为
如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4•10H2O)在温度为
T3 K 时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )
 如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4•10H2O)在温度为
如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4•10H2O)在温度为T3 K 时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )
| A. | 32.8g | B. | 40g | C. | 40.8g | D. | 41g |
3.1mol•L-1 NaCl溶液的含义是( )
| A. | 1L水中含有1mol NaCl | |
| B. | 溶液中含有1mol NaCl | |
| C. | 1L溶液中含有58.5g NaCl | |
| D. | 将58.5g NaCl溶于1L水中所得的溶液 |
 某温度下的溶液中c(H+)=1.0×10x mol/L,c(OH-)=1.0×10y mol/L.x与y的关系如图所示.请回答下列问题:
某温度下的溶液中c(H+)=1.0×10x mol/L,c(OH-)=1.0×10y mol/L.x与y的关系如图所示.请回答下列问题: 室温时向100mL,0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液PH与NaOH溶液体积的关系曲线如图B所示:
室温时向100mL,0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液PH与NaOH溶液体积的关系曲线如图B所示: