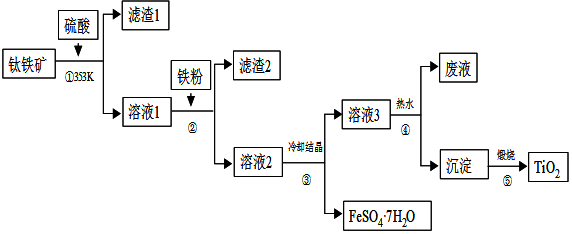
题目内容
3.1mol•L-1 NaCl溶液的含义是( )| A. | 1L水中含有1mol NaCl | |
| B. | 溶液中含有1mol NaCl | |
| C. | 1L溶液中含有58.5g NaCl | |
| D. | 将58.5g NaCl溶于1L水中所得的溶液 |
分析 结合n=cV及1mol/L指1L溶液中含1molNaCl计算.
解答 解:A.1L水为溶剂的体积,故A错误;
B.1mol•L-1 NaCl溶液的含义是1L溶液中含有1mol NaCl,故B错误;
C.1L溶液中含有NaCl为1L×1mol/L×58.5g/mol=58.5g,故C正确;
D.溶于1L水,溶液体积未知,不能计算,故D错误;
故选C.
点评 本题考查物质的量浓度计算,为高频考点,把握体积、浓度、物质的量的关系为解答的关键,侧重分析与应用能力的考查,注意溶液体积的判断,题目难度不大.

练习册系列答案
相关题目
13.下列化学方程式,不正确的是( )
| A. | Fe+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2 | B. | Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 | ||
| C. | N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO | D. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl |
14.荧光黄既可用作颜料,也可用作指示剂,其合成路线如图:
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | X分子中所有原子可以处于同一平面 | |
| B. | Y可命名为邻苯二甲酸二乙酯 | |
| C. | 1mol荧光黄最多可与含3molNaOH的溶液完全反应 | |
| D. | 荧光黄中只有两种官能团 |
11.下列事实能说明物质的性质影响化学反应速率的是( )
| A. | 常温下,二氧化锰与浓盐酸不反应,而高锰酸钾与浓盐酸反应产生氯气 | |
| B. | 接触面相近的锌粒与1mo1•L-1的盐酸反应比1mo1•L-1的硫酸反应快 | |
| C. | 同质量的煤块在空气中燃烧比煤粉燃烧要慢 | |
| D. | 甲烷与氯气的混合气体在暗室中黄绿色变浅速率比在太阳照射下慢 |
8.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1LpH=1的溶液中含有的H+数目为NA | |
| B. | 常温常压下,22.4LCH4含有的分子数为NA | |
| C. | 1molNa2O2固体中含有的离子总数为3NA | |
| D. | 1mol•L-1NaCl溶液中含有的Cl-数目为NA |
15.能用H++OH-═H2O来表示的化学反应是( )
| A. | 纯碱与盐酸反应 | B. | Ba(OH)2和H2SO4溶液反应 | ||
| C. | KOH溶液和亚硫酸溶液反应 | D. | NH4HSO4溶液和少量NaOH溶液反应 |
12.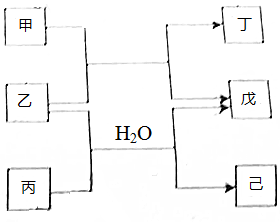 短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
 短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )| A. | 简单离子半径:r(Z)>r(R)>r(X)>r(Y) | |
| B. | X,Y,Z的最高价氧化物对应的水化物相互反应 | |
| C. | R,E,Z可存在于同一种共价化合物中 | |
| D. | Z的阴离子夺质子能力较R的阴离子强 |
1.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 在NaHCO3溶液中c(Na+)>c(HCO3-)+2c(H2CO3) | |
| B. | 25℃时,pH=4.75、浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 室温下,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 10mL0.1mol•L-1 CH3COOH溶液加入一定质量的量的NaOH后,溶液中离子的浓度由大到小的顺序可能是:c(Na+)>c(CH3COO-)+)>c(OH-)>c(H+) |