题目内容
9.有100mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.4mol/L,c(Cl-)为2.0mol/L,使Mg2+全部转化为沉淀分离出来,至少需加4mol/L的NaOH溶液的体积为( )| A. | 50mL | B. | 60mL | C. | 70mL | D. | 80mL |
分析 根据MgCl2和AlCl3的混合溶液与碱的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+恰好转化为AlO2-,先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算即可.
解答 解:MgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.4mol•L-1,Cl-浓度为2.0mol•L-1,
设Al3+的浓度为x,由电荷守恒可知,
0.4mol/L×2+x×3=2.0mol/L×1,
解得x=0.4mol/L,
则将Mg2+、Al3+的物质的量分别为0.1L×0.4mol/L=0.04mol、0.1L×0.4mol/L=0.04mol,
由发生反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl
1 2
0.04mol 0.08mol
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.04mol 0.16mol
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.16mol=0.24mol,
则需加4mol•L-1NaOH溶液的体积为$\frac{0.24mol}{4mol/L}$=0.06L=60mL,
故选B.
点评 本题考查离子的分离及利用化学反应方程式的计算,为高频考点,把握Mg2+全部转化为沉淀分离出来发生的化学反应是解答本题的关键,并注意利用氢氧化铝的两性来解答,题目难度不大.

练习册系列答案
相关题目
11.下列事实能说明物质的性质影响化学反应速率的是( )
| A. | 常温下,二氧化锰与浓盐酸不反应,而高锰酸钾与浓盐酸反应产生氯气 | |
| B. | 接触面相近的锌粒与1mo1•L-1的盐酸反应比1mo1•L-1的硫酸反应快 | |
| C. | 同质量的煤块在空气中燃烧比煤粉燃烧要慢 | |
| D. | 甲烷与氯气的混合气体在暗室中黄绿色变浅速率比在太阳照射下慢 |
12.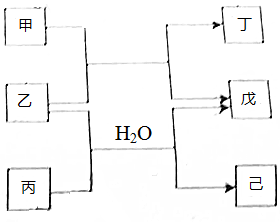 短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
 短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )| A. | 简单离子半径:r(Z)>r(R)>r(X)>r(Y) | |
| B. | X,Y,Z的最高价氧化物对应的水化物相互反应 | |
| C. | R,E,Z可存在于同一种共价化合物中 | |
| D. | Z的阴离子夺质子能力较R的阴离子强 |
17.下列物质属于电解质的是( )
| A. | 金属铜 | B. | 氯化钠溶液 | C. | 硝酸钾固体 | D. | 二氧化碳 |
4.在下列各溶液中,离子可能大量共存的是( )
| A. | 加入铝粉能产生H2的溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 加入Na2O2的溶液中:K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
14.在实验室进行下列实验,括号内的实验仪器或试剂都能用到的是( )
| A. | 铝热反应(铝热剂、镁带、氯酸钾、蒸发皿) | |
| B. | 钠的焰色反应(氯化钠溶液、盐酸、铂丝、蓝色钴玻璃) | |
| C. | 中和热的测定(量筒、温度计、环形玻璃搅拌棒、酒精灯) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、烧杯、胶头滴管) |
1.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 在NaHCO3溶液中c(Na+)>c(HCO3-)+2c(H2CO3) | |
| B. | 25℃时,pH=4.75、浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 室温下,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 10mL0.1mol•L-1 CH3COOH溶液加入一定质量的量的NaOH后,溶液中离子的浓度由大到小的顺序可能是:c(Na+)>c(CH3COO-)+)>c(OH-)>c(H+) |
18.欲配制pH=13.00的溶液10.0dm3,所需NaOH固体的质量是(相对原子质量:Na 23)( )
| A. | 40g | B. | 4.0g | C. | 4.0×10-11g | D. | 4.0×10-12g |
19.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中“●”和“○”分别代表不同元素的原子.关于此反应说法不正确的是( )


| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 该反应可表示为: = = + + |