题目内容
2.常温下,下列各组离子一定能大量共存的是( )| A. | c(H+)=10-4mol•L-1的溶液中:NH4+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、Cu2+、Cl-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、I- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
分析 A.四种离子之间不发生反应,都不与氢离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.硫酸根离子、碘离子都与银离子反应;
D.饱和氯水具有氧化性,能够氧化亚硫酸根离子.
解答 解:A.NH4+、K+、SO42-、NO3-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.Cu2+为有色离子,不满足溶液无色的要求,故B错误;
C.SO42-、I-与AgNO3反应,在溶液中不能大量共存,故C错误;
D.SO32-具有还原性,能够被饱和氯水氧化,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
9.下列实验装置或实验操作能达到相应实验目的是( )
| A | B | C | D |
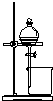 | 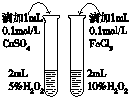 | 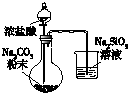 | 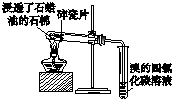 |
| 用于分离苯萃取碘水后的有机层和水层 | 比较不同种催化剂对反应速率的影响 | 验证酸性:H2CO3>H2SiO3 | 证明石蜡油分解生成的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
10.新型 NaBH4/H2O2燃料电池(DBFC)的结构如图,(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )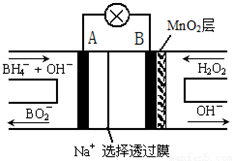

| A. | 放电过程中,正极附近溶液中的H+浓度减小 | |
| B. | 电池正极区的电极反应为:BH${\;}_{4}^{-}$+8OH--8e-=BO$_2^-$+6H2O | |
| C. | 放电过程中,Na+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
17.化学与工农业生产、人类生活密切相关.下列说法中不正确的是( )
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
14.下列物质中,长期露置在空气中,不会变质的是( )
| A. | AgI | B. | 漂白粉 | C. | 食盐 | D. | 次氯酸钙溶液 |
11.某有机物分子式为C5H10Cl2,其主链有4个碳原子的同分异构体共有多少种( )
| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
12.硫酸厂有一辆存放过浓硫酸的铁槽车,某新工人违反操作规程,边吸烟边用水冲洗,结果发生了爆炸事故.下列所述引起爆炸的原因,正确的是( )
| A. | 硫酸遇明火发热爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生氢气,氢气接触空气后遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生氢气接触明火爆炸 |
 .
. .
. ;
;