题目内容
7.X、Y、Z均为短周期元素,且原子序数依次递增,其中X元素的单质是自然界最轻的气体,Y元素的氧化物YO2是形成酸雨的主要气体,Z元素原子的最外层电子数比次外层电子数少1.回答下列问题:(1)写出X元素的符号H;
(2)画出Z的原子结构示意图
 ;
;(3)Y元素在元素周期表中的位置第三周期第ⅥA族;
(4)Y与Z两种元素的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
分析 X、Y、Z均为短周期元素,且原子序数依次递增,其中X元素的单质是自然界最轻的气体,故X为H元素;Y元素的氧化物YO2是形成酸雨的主要气体,Y为S元素;Z元素原子的最外层电子数比次外层电子数少1,原子序数大于S,处于第三周期,最外层电子数为7,则Z为Cl.
解答 解:X、Y、Z均为短周期元素,且原子序数依次递增,其中X元素的单质是自然界最轻的气体,故X为H元素;Y元素的氧化物YO2是形成酸雨的主要气体,Y为S元素;Z元素原子的最外层电子数比次外层电子数少1,原子序数大于S,处于第三周期,最外层电子数为7,则Z为Cl,
(1)由上述分析可知,X为H元素,故答案为:H;
(2)Z为Cl元素,原子核外有17个电子,有3个电子层,最外层电子数为7,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)Y为S元素,原子质子数为16,有3个电子层,最外层电子数为6,在元素周期表中处于第三周期第ⅥA族.
故答案为:第三周期第ⅥA族;
(4)非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性Cl>D,所以两种元素的最高价氧化物对应水化物的酸性较强的是HClO4,故答案为:HClO4.
点评 本题考查元素推断、常用化学用语、元素周期律、结构位置关系等内容,题目注重基础知识的考查,难度不大.

练习册系列答案
相关题目
14.下列微粒电子式错误的是( )
| A. | 氯原子:$\underset{\stackrel{••}{Cl}}{••}$• | B. | 硫离子:$\underset{\stackrel{••}{S}}{••}$:2- | C. | 溴离子[:$\underset{\stackrel{••}{Br}}{••}$:]- | D. | 钙离子Ca2+ |
18.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1实验装置进行铝热反应,冷却后得到“铁块”混合物.
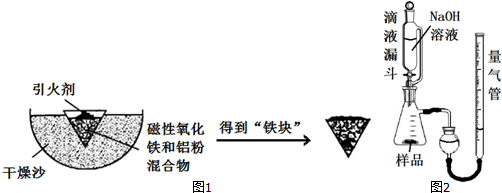
(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图3所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图3所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
2.常温下,下列各组离子一定能大量共存的是( )
| A. | c(H+)=10-4mol•L-1的溶液中:NH4+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、Cu2+、Cl-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、I- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
19.钠放入盛有空气的密闭容器中生成Na2O和Na2O2,这是下列哪些因素决定的( )
| A. | 反应温度 | B. | 空气的量 | C. | 钠粒的大小 | D. | 钠的状态 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023 | |
| D. | 标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
17.某元素基态原子失去3个电子后,3d轨道半充满,其原子序数为( )
| A. | 24 | B. | 25 | C. | 26 | D. | 27 |
 ;
; 氮元素可形成卤化物、叠氮化物及配合物等
氮元素可形成卤化物、叠氮化物及配合物等