题目内容
14.下列物质中,长期露置在空气中,不会变质的是( )| A. | AgI | B. | 漂白粉 | C. | 食盐 | D. | 次氯酸钙溶液 |
分析 长期露置在空气中,易光照分解或与空气中的水、二氧化碳反应等,则易发生变质,反之不会变质,以此来解答.
解答 解:A.AgI可光照分解,会变质,故A不选;
B.漂白粉与空气中的水、二氧化碳反应,会变质,故B不选;
C.NaCl性质稳定,不分解、不与水、二氧化碳反应,不会变质,故C选;
D.次氯酸钙溶液与空气中的二氧化碳反应,会变质,故D不选;
故选C.
点评 本题考查物质的性质及变质问题,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
4.某溶液中的离子只有NH4+、Cl-、H+和OH-四种,下列描述正确的是( )
| A. | 该溶液中的溶质只有NH4Cl | |
| B. | 当溶液呈碱性时:c(NH4+)+c(H+)<c(Cl-)+c(OH-) | |
| C. | 溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 该溶液可能由pH=12的氨水与pH=2的HCl溶液等体积混合而成 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.1 mol-NH2中含有的电子数为0.7NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
2.常温下,下列各组离子一定能大量共存的是( )
| A. | c(H+)=10-4mol•L-1的溶液中:NH4+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、Cu2+、Cl-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、I- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
9.如图为雾霾的主要成分示意图.下列说法错误的是( )
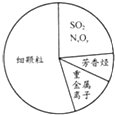

| A. | SO2、NxOy都属于酸性氧化物 | |
| B. | 碳氢化合物和氮氧化合物可引起光化学烟雾 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
19.钠放入盛有空气的密闭容器中生成Na2O和Na2O2,这是下列哪些因素决定的( )
| A. | 反应温度 | B. | 空气的量 | C. | 钠粒的大小 | D. | 钠的状态 |
6.强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1:下面三个热化学方程式
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O (l);△H=-Q1kJ•mol-1
H2SO4(浓)+2NaOH(aq)═Na2SO4(aq)+2H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O (l);△H=-Q1kJ•mol-1
H2SO4(浓)+2NaOH(aq)═Na2SO4(aq)+2H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
4.下列说法正确的是( )
| A. | 往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 |
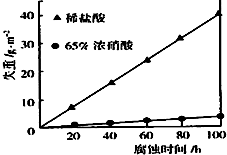 按要求回答下列问题:
按要求回答下列问题: